-
化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
D.屠呦呦提取青蒿素加入乙醚萃取,此过程属于化学变化
难度: 中等查看答案及解析
-
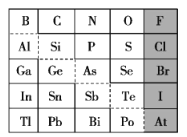
应用元素周期律分析下列推断,其中正确的组合是( )
①第ⅡA族单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③⑥ B.②④⑥ C.③④⑤ D.①③④
难度: 中等查看答案及解析
-
中国在探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等方面取得了举世瞩目的成就,它们与化学有着密切联系,下列说法正确的是( )
A.中国天眼的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料
B.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是二氧化硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.水分子的比例模型:
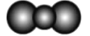
B.过氧化氢的电子式为:
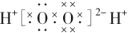
C.正丁烷的球棍模型:
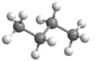
D.乙烯的结构式:CH2=CH2
难度: 简单查看答案及解析
-
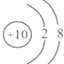
据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20.下列叙述正确的是( )
A.10B20为硼元素的一种原子
B.10B20为硼元素的一种单质
C.10B20的中子数比核外电子数多
D.10B的原子核外电子排布为
难度: 中等查看答案及解析
-
下列反应是吸热反应的是
A.
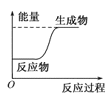
B.
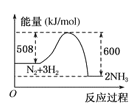
C.
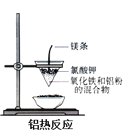
D.
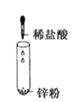
难度: 中等查看答案及解析
-
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化所引起的化学键及能量的变化,下列叙述错误的是( )
A.化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成
B.需要加热才能发生的反应一定是吸热反应
C.燃烧可看成“储存”在物质内部的能量转化为热能、光能并释放出来
D.破坏化学键所吸收的能量大于形成化学键所释放的能量,这样的反应是吸热反应
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.氯化钠熔化时克服离子键,碘升华克服共价键
B.HF分子很稳定是由于HF分子之间能形成氢键
C.一氯甲烷只有一种空间结构,证明甲烷是正四面体的空间结构而不是平面结构
D.分子式为C5H12O且能与钠反应的有机物的同分异构体有8种
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,下列有关该有机物的叙述正确的是( )

A.该有机物的分子式为C11H14O3
B.该有机物共有四种官能团,分别为:碳碳双键、苯环、羟基、羧基
C.该有机物最多消耗NaOH与NaHCO3的物质的量之比为2:1
D.1mo1该有机物在Ni作催化剂的条件下能与4mo1H2发生加成反应
难度: 简单查看答案及解析
-
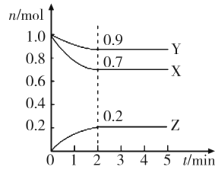
两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+B⇌mC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1•L-1•min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1•L-1•min-1
D.m值为2
难度: 中等查看答案及解析
-
反应H2(g)+I2(g)
2HI(g)为放热反应,若在恒容绝热的容器中发生,下列选项表明已达平衡状态的是( )
A.气体的总物质的量不再变化
B.容器内的压强不再变化
C.相同时间内,断开H-H键的数目和生成H—I键的数目相等
D.容器内气体的浓度c(H2):c(I2):c(HI)=1:1:2
难度: 中等查看答案及解析
-
反应A+3B=2C+D在四种不同情况下的反应速率分别为①v(A)=0.15mol·L-1·s-1,②v(B)=0.6mol·L-1·s-1,③v(C)=0.5mol·L-1·s-1,④v(D)=0.45mol·L-1·s-1。
则反应进行的快慢顺序为( )
A.④>③>①>② B.②>④>③>①
C.②>③>④>① D.④>③>②>①
难度: 中等查看答案及解析
-
某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加适量的水配成溶液,在蔗糖溶液中加入3~5滴稀硫酸,将混合溶液煮沸几分钟后冷却,在冷却后的溶液中加入新制的Cu(OH)2悬浊液煮沸几分钟,实验结果没有砖红色沉淀产生,其原因是( )
A.蔗糖尚未水解
B.加热时间不够
C.煮沸后的溶液没有加碱
D.蔗糖水解的产物没有葡萄糖
难度: 中等查看答案及解析
-
X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
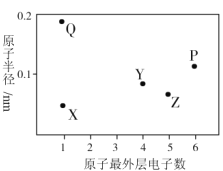
A.Q与氧形成的某化合物中可能含有离子键和非极性键
B.最高价氧化物对应水化物的酸性:Z<Y
C.P的最低价氢化物水溶液久置于空气中会产生浑浊
D.简单离子半径大小为:P>Z>Q>X
难度: 中等查看答案及解析
-
给某潜水器提供动力的电池如图所示。下列有关说法正确的是( )

A.Zn极发生了还原反应
B.电池中的Na+向Zn电极移动
C.Pt电极反应式为H2O2+2e-=2OH-
D.电子从Zn电极沿导线流向Pt电极,再经溶液回到Zn电极
难度: 简单查看答案及解析
-
Zu1emaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
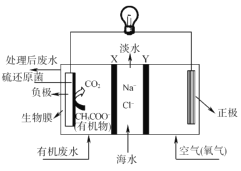
A.该装置可以在高温下工作
B.正极附近溶液的pH值减小
C.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D.该装置工作时,电能转化为化学能
难度: 简单查看答案及解析
-
苯环实际上不具有碳碳单键和双键的交替结构,可以作为证据的事实有( )
①苯的间位二取代物只有一种
②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等
④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色
A.①②③④ B.②③④⑥ C.③④⑤⑥ D.全部
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物KC1的焰色为紫色;K2CO3的焰色也为紫色
④生铁比纯铁的熔点低;钠钾合金的熔点也应介于Na和K熔点之间
A.①② B.①④ C.①②③④ D.①②④
难度: 简单查看答案及解析