-
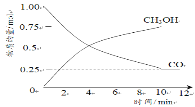
最近我国全球首次海域试开采可燃冰圆满成功。与可燃冰释放出的气体成分相同的是
A.天然气 B.水煤气 C.裂解气 D.焦炉煤气
难度: 简单查看答案及解析
-
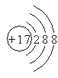
Si是制造量子计算机的理想材料,这里的“28”是指该原子的
A.质子数 B.中子数 C.电子数 D.质量数
难度: 简单查看答案及解析
-
下列物质均可用作燃料电池的燃料,其中最环保的是
A.氢气 B.甲烷 C.甲醇 D.汽油
难度: 中等查看答案及解析
-
下列有机物中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是
A.乙烷 B.乙烯 C.乙炔 D.乙醇
难度: 简单查看答案及解析
-
下列物质放入水中,会显著放热的是( )
A.食盐 B.生石灰 C.硝酸铵 D.蔗糖
难度: 简单查看答案及解析
-
下列含有共价键的离子化合物是
A.CO2 B.NaOH C.CaF2 D.金刚石
难度: 中等查看答案及解析
-
减少酸雨产生的合理措施( )
①把工厂烟囱造高②燃料脱硫③开发洁净能源④在酸化土壤中加入石灰⑤用煤作燃料
A.①②⑤ B.①②③④ C.②③ D.②④⑤
难度: 简单查看答案及解析
-
构成氯化钠的两种微粒的结构示意图是下列的
①
②
③
④
⑤
⑥
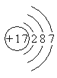
A.①⑥ B.②⑤ C.③④ D.③⑤
难度: 简单查看答案及解析
-
下列各组中的两种物质互为同分异构体的有
①乙醇和二甲醚 ②正丁烷和异丁烷 ③金刚石和富勒烯 ④
和
⑤蔗糖和麦芽糖 ⑥蛋白质和氨基酸
A.③④⑥ B.①②④ C.①②⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
下列属于加成反应的是
A.CH2=CH2+ HCl
CH3CH2Cl
B.CH3CH3+ Cl2
CH3CH2Cl + HCl
C.C2H5OH + 3O2
2CO2+ 3H2O
D.
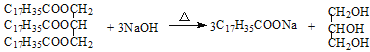
难度: 中等查看答案及解析
-
能源是人类可持续发展面临的重要问题,某科学家设计的UT-3热化学循环如下图所示:
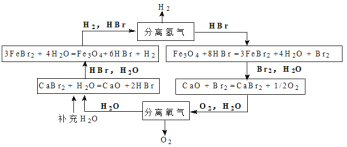
该过程最终制得的能源气体是
A.H2 B.O2 C.HBr D.Br2
难度: 中等查看答案及解析
-
有关SO2催化氧化反应(2SO2+O2
2SO3)的说法正确的是
A.升高温度可减慢反应速率
B.使用催化剂可提高反应速率
C.达到平衡时,
(正)=
(逆) =0
D.达到平衡时SO2转化率可达100%
难度: 简单查看答案及解析
-
下列过程只需要克服分子间作用力的是
A.HCl气体溶于水 B.碘单质升华
C.氯化镁受热熔化 D.二氧化硅受热熔化
难度: 简单查看答案及解析
-
下列物质中属于原子晶体的化合物是
A.金刚石 B.食盐 C.二氧化硅 D.干冰
难度: 简单查看答案及解析
-
图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是
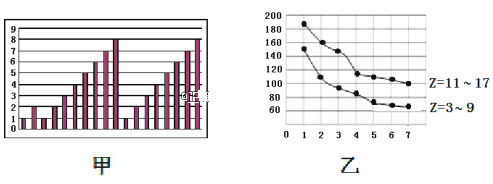
A.图甲横坐标为原子序数,纵坐标表示元素的最高正价
B.图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C.图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D.图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
难度: 中等查看答案及解析
-
某同主族(或同周期)元素的主要化合价的变化规律如右图所示,它们可能位于周期表
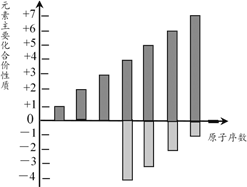
A.ⅠA族 B.ⅡA族
C.第二周期 D.第三周期
难度: 中等查看答案及解析
-
下列物质转化可通过一步加成反应实现的是
A.CH2=CH2
CH3CH2OH
B.C2H5OH
CH3CHO
C.
D.硬脂酸甘油酯
甘油
难度: 简单查看答案及解析
-
下列说法正确的是
A.燃料的燃烧都是放热反应
B.氯化钾的电子式为:
C.决定化学反应速率的主要因素是反应物的浓度
D.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
难度: 简单查看答案及解析
-
下列实验操作不能达到相应实验目的的是
选项
实验目的
实验操作
A
比较水与乙醇中氢的活泼性
分别将少量钠投入到乙醇和水中,观察现象
B
检验淀粉酸性水解液中含葡萄糖
向水解液中直接加入少量Cu(OH)2悬浊液,加热
C
提纯含有少量乙酸的乙酸乙酯
试样中加入足量饱和碳酸钠溶液,振荡后静置分液,并除去有机层中的水
D
验证温度对化学反应速率的影响
在两支试管中各加入5mL12%H2O2 溶液,将其中一支用水浴加热,观察并比较实验现象
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X的原子失去一个电子后即为质子,X、Z同主族,Y的原子L层有5个电子,W的单质常温下呈气态。下列说法正确的是
A.原子半径:r(X)<r(Y)<r(Z)<r(W)
B.Y的最高价氧化物的水化物酸性比W的强
C.Z的一种氧化物可能既含离子键又含共价键
D.X、Y、W三种元素一定只能组成共价化合物
难度: 中等查看答案及解析
-
石油蒸馏装置如图所示。下列说法正确的是
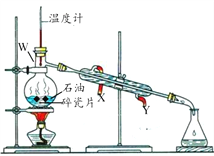
A.仪器W的名称是:圆底烧瓶
B.碎瓷片的作用是:催化剂
C.冷却水的流向是:X进Y出
D.收集到的60~150℃的馏分为混合物
难度: 简单查看答案及解析
-
将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g), 若经 2 s后测得 C的浓度为 0.6 mol•L-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 mol•L-1•s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 mol•L-1
其中正确的是
A.①④ B.②③ C.①③ D.③④
难度: 简单查看答案及解析
-
英国科学家发明的尿素微生物电池的反应为:2CO(NH2)2+3O2 = 2CO2+2N2+4H2O,电池装置如图所示。下列说法正确的是
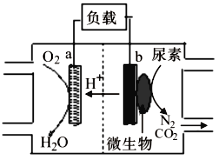
A.该装置能够在高温下工作
B.微生物促进了反应中电子的转移
C.装置工作时,电能转变为化学能
D.装置工作时,电子由电极a沿导线流向电极b
难度: 中等查看答案及解析
-
一种生产聚苯乙烯的流程如下:

下列叙述不正确的是
A.苯乙烯的分子式为C8H8
B.1mol苯乙烯最多可与4molH2发生加成反应
C.鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液
D.乙烯、苯和乙苯的分子中所有原子均可处于同一平面
难度: 简单查看答案及解析
-
某课外活动小组用下图装置进行实验,K接N,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为 g,石墨极上产生的物质的物质的量为 mol。
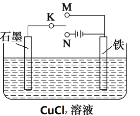
A.3.2 0.05 B.0.05 3.2 C.3.2 3.2 D.0.05 0.05
难度: 中等查看答案及解析