-
只含有离子键的化合物是
A.NaOH B.HNO3 C.Mg3N2 D.SiO2
难度: 简单查看答案及解析
-
实验室进行石油分馏实验,不需要用到的仪器是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列属于非电解质的是
A.苯酚 B.镁铝合金 C.过氧化钠 D.乙烯
难度: 中等查看答案及解析
-
反应 SiO2+2C
Si+2CO↑中,氧化产物是
A.CO B.C C.SiO2 D.Si
难度: 简单查看答案及解析
-
下列物质的名称正确的是
A.NaHCO3:纯碱 B.Na2SO4:芒硝
C.CH3OCH3:二甲醚 D.CH2Br-CH2Br:二溴乙烷
难度: 简单查看答案及解析
-
下列表示正确的是
A.氖分子的电子式:
B.乙醇的结构式:
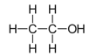
C.硫离子的结构示意图:
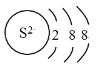 D.CH4 分子的球棍模型:
D.CH4 分子的球棍模型: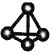
难度: 中等查看答案及解析
-
下列说法正确的是
A.H2 与 D2 互为同位素
B.C70 和单层纳米碳管互为同素异形体
C.乙烯和
互为同系物
D.淀粉和纤维素都可以用(C6H10O5)n 表示,它们互称为同分异构体
难度: 简单查看答案及解析
-
下列说法不正确的是
A.臭氧具有强氧化性,可用作饮用水的杀菌消毒剂
B.海水中含有丰富的碘元素,因此碘被称为“海洋元素”
C.某些特殊用途产品可用水玻璃浸泡后,既耐腐蚀又不易着火
D.火山附近的温泉因常常含有游离态硫而具有杀菌作用
难度: 中等查看答案及解析
-
下列说法不正确的是
A.金属钙和水、苯酚、乙醇、乙酸均能反应
B.使用带盐桥的原电池装置,可使化学能转化为电能的效率提高
C.铝单质可以从 MnO2 中置换出 Mn
D.尿素与乙醛在一定条件下反应生成脲醛树脂,可用于生产热固性高分子黏合剂
难度: 简单查看答案及解析
-
下列说法不正确的是
A.光--电转换的途径可以不需要发生化学反应
B.天然气和沼气的主要成分都是甲烷,因此都是化石能源
C.将厨余垃圾中的油脂分离出来,可以制造肥皂和油漆等
D.人造丝、人造棉和铜氨纤维的主要化学成分都可表示为(C6H10O5)n
难度: 中等查看答案及解析
-
下列有关实验说法,不正确的是
A.可以用 KI—淀粉溶液(稀硫酸酸化)鉴别亚硝酸钠和食盐
B.金属汞洒落在地上,应尽可能收集起来,并用硫磺粉盖在洒落的地方
C.用纸层析法分离 Fe3+和 Cu2+,由于 Fe3+亲水性更强,因此 Fe3+在滤纸上流动的快些
D.在用简易量热计测定反应热时,酸和碱迅速混合并用环形玻璃搅拌棒搅拌,准确读取温度计最高示数并记录温度
难度: 中等查看答案及解析
-
下列关于氮及其化合物说法,不正确的是
A.“雷雨发庄稼”是由于放电条件有利于游离态的氮转化为化合态
B.二氧化氮不仅能形成酸雨,还能在一定条件下促进形成“光化学烟雾”
C.铵态氮肥应保存在阴凉处,硝态氮肥(硝酸盐)则能够耐高温
D.工业上制备硝酸过程中,氨催化氧化放出大量热,能预热新进入设备的氨气和空气,节约能源
难度: 中等查看答案及解析
-
能够正确表示下列变化的离子方程式是
A.醋酸钠的水【解析】
CH3COOH+H2O⇌CH3COO−+H3O+B.电解熔融MgCl2:Mg2++2Cl−
Mg+Cl2↑
C.MnO2 与浓盐酸共热:MnO2+4HCl
Mn2++Cl2↑+2H2O
D.K2S溶液中滴加几滴FeCl3溶液:
难度: 中等查看答案及解析
-
下列说法不正确的是
A.固态氨基酸主要以内盐形式存在,熔点较高,易溶于有机溶剂
B.可用苯将含苯酚废水中的苯酚萃取出来
C.溴苯中混有的少量溴单质,可加入足量的 10﹪NaOH 溶液,经分液除去
D.用新制氢氧化铜悬浊液(必要时可加热)能鉴别丙三醇、乙醇、乙醛和乙酸
难度: 中等查看答案及解析
-
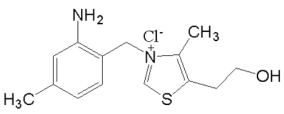
瑞巴派特片是一种胃药,其主要成分结构如图。 下列关于它的说法,正确的是
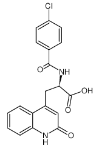
A.该物质不能使酸性高锰酸钾溶液褪色
B.该物质的分子式为 C19H17ClN2O4
C.1 mol 该物质能与 10mol 氢气发生加成反应
D.该物质能水解,水解产物中含有氨基酸
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大, Y 在同周期主族元素中原子半径最大,Y分别与 X、Z、W 形成二元化合物甲、乙、丙,其 0.1mol·L-1 水溶液近似 pH(常温)如下表:
甲
乙
丙
近似 pH 值
8
12
7
下列说法不正确的是
A.甲、丙的晶体类型相同,且熔点:甲>丙
B.由 Y 和 Z 组成的二元化合物中不可能含共价键
C.原子半径:r(Y) > r(Z) > r(W) > r(X)
D.X 的简单气态氢化物的热稳定性比 W 的强
难度: 困难查看答案及解析
-
下列说法正确的是
A.100℃时,将 pH=2 的盐酸与 pH=12 的 NaOH 溶液等体积混合,溶液显中性
B.相同温度下,pH 相等的氨水、CH3COONa 溶液中,水的电离程度相同
C.相同物质的量浓度的盐酸和醋酸分别加水稀释到相同 pH,醋酸中加水多
D.将浓度为 c1 的氨水和浓度为 c2 的盐酸等体积混合,若溶液呈中性,则一定有 c1> c2
难度: 中等查看答案及解析
-
以碘为原料,通过电解制备 KIO3 的实验装置如右图所示。电解前,先将一定量的精制碘溶于过 量 KOH 溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入某电极区。将 KOH 溶液加入另一电极区,电解槽用水冷却。下列说法不正确的是
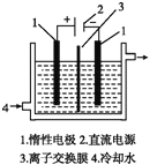
A.产品 KIO3 在阳极区得到 B.离子交换膜为阴离子交换膜
C.电解时,须不断补充 KOH D.阴极区加入的是 KOH 溶液,发生还原反应生成 H2
难度: 中等查看答案及解析
-
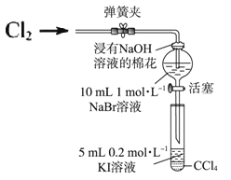
排水法收集气体实验中,用饱和食盐水代替水收集氯气,可降低氯气 的溶解损失。下列说法不正确的是
A.Cl2(g)⇌Cl2(aq),增大溶液中 Cl2(aq)浓度可抑制氯气的溶解
B.增大溶液中的 Cl−(aq)浓度,有利于增大 Cl2(aq)浓度,从而抑制氯气的溶解
C.Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq),饱和食盐水可抑制反应进行
D.若实验中改用碳酸钠溶液代替水收集氯气,亦可减少氯气的损失
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列说法不正确的是
A.1mol CH4 与 Cl2 在光照下反应生成的CH3Cl分子数等于NA
B.100 g CaCO3 和 KHCO3 的固体混合物中含有的阳离子数为 NA
C.一定浓度的硫酸和镁反应,生成 11.2L(标准状况)气体,转移电子数为 NA
D.6.4g SO2 溶于水形成的酸雨中,SO2、H2SO3、HSO
和 SO
的微粒数之和为 0.1NA
难度: 困难查看答案及解析
-
一定温度下,在 5 L 的恒容密闭容器中发生反应N2(g)+3H2(g)⇌2NH3(g)。反应过程中的部分数据如下表所示:
n/mol
t/min
N(N2)
N(H2)
N(NH3)
0
a
24
0
5
13
6
10
12
15
8
下列说法正确的是
A.N2 的初始浓度为16 mol·L−1
B.0~5 min 用H2表示的平均反应速率为0.24 mol·L−1·min−1
C.平衡状态时,c(N2)=2.6 mol·L−1
D.N2 的平衡转化率为 25%
难度: 中等查看答案及解析
-
十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18→C10H12→C10H8”的脱氢过程释放氢气。
反应Ⅰ:C10H18(l) →C10H12(l)+3H2(g)△H1
反应Ⅱ:C10H12(l) →C10H8(l)+2H2(g)△H2
在一定温度下,其反应过程对应的能量变化如图。 下列说法不正确的是
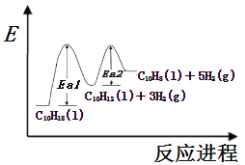
A.△H1>△H2>0
B.Ea1 为反应Ⅰ的活化能,Ea2为反应Ⅱ的活化能
C.由图知,反应Ⅰ的活化分子百分率高于反应Ⅱ
D.C10H18脱氢过程中,不会有大量中间产物C10H12积聚
难度: 中等查看答案及解析
-
已知 K2FeO4 溶于水后,会水解生成多种微粒。下图是0.10 mol·L−1 K2FeO4 溶液中各含铁微粒随溶液 pH 的变化图,纵坐标表示其个数百分含量,则下列说法不正确的是
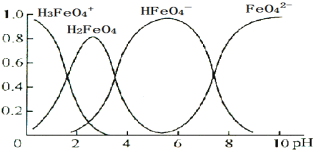
A.K2FeO4 溶于水呈碱性 B.
水解强于电离
C.H2FeO4 既能和强碱反应又能和强酸反应 D.0.10 mol·L−1 的 K2FeO4 的 pH 近似等于 10
难度: 中等查看答案及解析
-
在碱性介质中,用 Cl2 氧化 KIO3 可制得正高碘酸钾(K2H3IO6)。下列说法不正确的是
A.正高碘酸钾可能具有强氧化性
B.正高碘酸化学式为 H5IO6 或(HO)5IO
C.正高碘酸钾可由正高碘酸和 KOH 反应得到
D.正高碘酸受热得到偏高碘酸(HOIO3)的反应是氧化还原反应
难度: 中等查看答案及解析
-
某固体混合物 X,含有 Al2(SO4)3、FeCl3、Na2CO3 和 Na2SiO3 中的几种,进行如下实验:①X 与水作用有气泡冒出,得到有色沉淀 Y 和弱碱性溶液 Z;②沉淀 Y 与足量 NaOH 溶液充分作用,部分溶解。 下列说法不正确的是
A.沉淀 Y 一定能溶于盐酸
B.溶液 Z 中溶质一定不含 Na2SiO3
C.混合物 X 至少含有三种成分
D.混合物 X 中一定含有 Na2CO3、FeCl3,可能含有 Al2(SO4)3
难度: 中等查看答案及解析

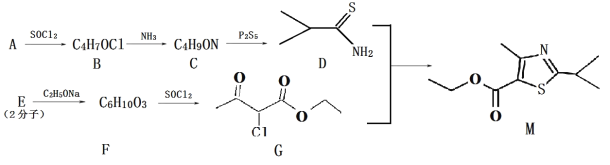
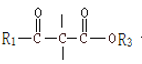 +R2OH (R1、R2、R3 均为烃基)
+R2OH (R1、R2、R3 均为烃基)