-
化学与生活、生产、社会可持续发展密切相关。下列说法错误的是( )
A.牙膏中添加的Na2PO3F、NaF所提供的氟离子浓度相等时,它们防治龋齿的作用相同
B.“光化学烟雾” “硝酸型酸雨”的形成都与氮氧化合物有关
C.用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用
D.碳纳米管比表面积大,可用作新型储氢材料
难度: 简单查看答案及解析
-
目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是
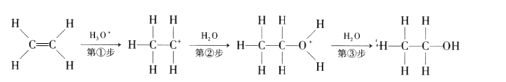
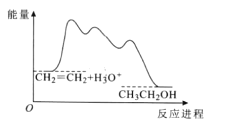
A.①、②、③三步反应均释放能量
B.该反应进程中有两个过渡态
C.第①步反应的活化能最小
D.总反应速率由第①步反应决定
难度: 中等查看答案及解析
-
有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述错误的是( )
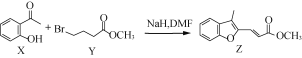
A.X中所有原子不可能在同一平面 B.X、Z均能与酸性KMnO4溶液反应
C.Y含有羧基的同分异构体有12种 D.室温下Z与Br2加成的产物最多有3种
难度: 中等查看答案及解析
-
硝基苯是一种重要有机合成中间体,实验室可用如下反应制备:
+HNO3
+H2O △H<0,已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
物质
苯
硝基苯
间二硝基苯
浓硝酸
浓硫酸
沸点/℃
80
211
301
83
338
溶解性
微溶于水
难溶于水
微溶于水
易溶于水
易溶于水
下列说法不正确的是( )
A.分液后的有机层,采用蒸馏的方法可将硝基苯首先分离出来
B.制备硝基苯的反应类型为取代反应
C.该反应温度控制在50~60℃的原因是减少反应物的挥发和副产物的生成
D.采用加入NaOH溶液、水洗涤、以及分液的方法可除去粗硝基苯中混有的无机杂质
难度: 简单查看答案及解析
-
Al—PMOF其结构如图(分子式:C4H9XYZ),可快速将芥子气降解为无毒物质。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法不正确的是
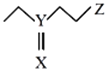
A.简单离子半径:Y>Z> X B.最简单氢化物稳定性:X >Z>Y
C.含氧酸酸性:Z>Y D.YXZ2中Y的化合价为+4
难度: 简单查看答案及解析
-
一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是
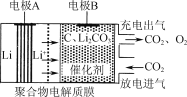
A.该电池放电时的正极反应为2Li-2e-+CO32-=Li2CO3
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-=3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
难度: 困难查看答案及解析
-
常温下,用pH传感器进行数字化实验,分别向两个盛50mL 0.100mol/L 盐酸的烧杯中匀速滴加50mL 去离子水、50mL 0.100mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如下图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是
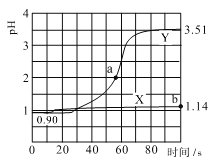
A.曲线X表示盐酸中加水稀释的pH变化
B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L
D.b点对应的溶液中水电离的c(H+)=10-12.86mol/L
难度: 困难查看答案及解析
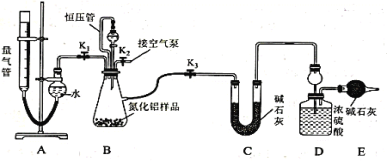
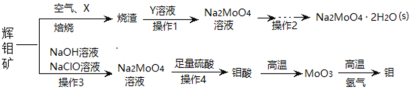
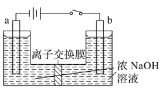
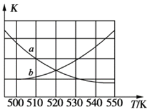
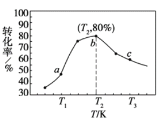
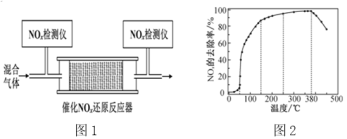
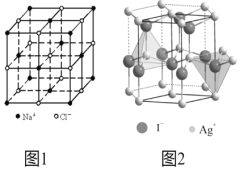
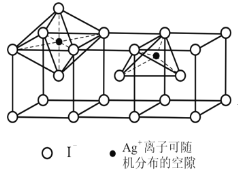
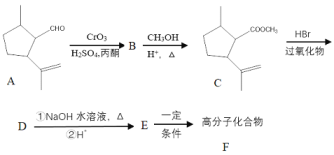
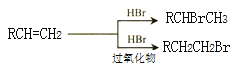
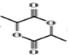 的合成路线______。
的合成路线______。