-
金属镍有广泛的有途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法备高纯度的镍,下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,电极反应式:Ni2++2e-=Ni
B.电解后,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有Cu和Pt
难度: 困难查看答案及解析
-
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句。下列说法不正确的是
A. 蚕丝的主要成分是蛋白质 B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应 D. “泪”是油酯,属于高分子聚合物
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A. lL0.lmol·L-1Na2S溶液中S2-和H2S的数目之和为0.1NA
B. 46g有机物C2H6O的分子结构中含有的C-H键数目一定为5NA
C. 60g的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2分子
D. 电解精炼铜,阳极溶解铜6.4g时,阴极得电子数目为0.2NA
难度: 中等查看答案及解析
-
在一定温度下,向一容积固定的密闭容器中充入2mol X,发生反应X(g)
Y(g)+Z(g),使反应达到平衡,X的转化率为a。若在相同温度下,向其中加入1mol X,当反应平衡后,X的转化率为b。则a和b的关系是
A. a>b B. a=2b C. a<b D. a=b
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Cu2+、Mg2+、NO
、SO
C.0.1mol·L-1FeCl3溶液中:Fe2+、NH
、SCN-、SO
D.无色溶液中:Cu2+、Al3+、
、Cl-
难度: 简单查看答案及解析
-
通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
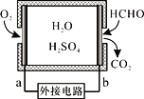
A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
难度: 中等查看答案及解析
-
最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法正确的是
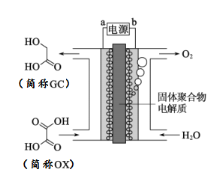
A. 电源的b极为负极
B. 在能量转换过程中,固体电解质中H+由阴极向阳极移动
C. 阴极电极反应式为:OX + 4H+ + 4e﹣═ GC + H2O
D. 为增强阳极电解液导电性,可在水中添加适量NaCl
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.l00mol·L-1的NaOH溶液滴定10.00mL浓度均0.l00mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中洛液的电导率如下图所示。下列说法不正确的是( )
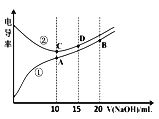
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C. 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D. B点溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
难度: 中等查看答案及解析
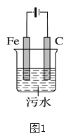

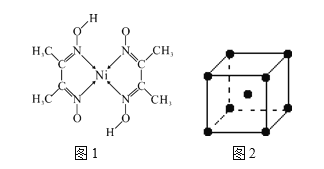
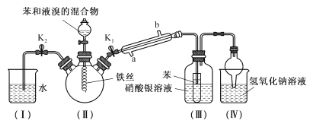
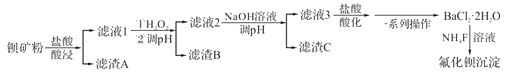
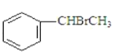 +H2O(卤烷基化反应);
+H2O(卤烷基化反应);