-
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl在光照和点燃条件下的△H不同
难度: 简单查看答案及解析
-
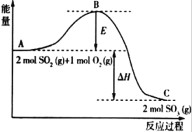
下列反应的能量变化与其它三个不相同的是
A.铝粉与氧化铁的反应
B.氯化铵与消石灰的反应
C.锌片与稀硫酸反应
D.钠与冷水反应
难度: 简单查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
—种化学冰袋中含有适量的Na2SO4·10H2O、NH4NO3、(NH4)2SO4、NaHSO4,将Na2SO4·10H2O和其他三种盐分别盛于两只塑料袋中,使用时将它们混合并用手揉搓就可制冷,制冷效果能维持2~3h。以下关于制冷原因的猜测肯定错误的是( )
A.Na2SO4·10H2O脱水是吸热过程
B.制冷时间较长是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热过程
D.NH4NO3溶于水会吸收热量
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.在101KPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热和中和热是反应热的种类之一
D.在稀溶液中,1mol乙酸和1mol氢氧化钠完全中和时放出的热量为57.3kJ
难度: 简单查看答案及解析
-
下列关于盖斯定律的说法不正确的是
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1。分别向1 L 0.5 mol·L-1的NaOH溶液中加入:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的ΔH的绝对值分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH3<ΔH1 C.ΔH1=ΔH2=ΔH3 D.ΔH2>ΔH3>ΔH1
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值、单位,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
B.在25℃、101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ/mol
C.在25℃、101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应
B. 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C. 物质燃烧都需要氧气
D. 物质燃烧放出热量的多少与外界条件有关
难度: 简单查看答案及解析
-
在
下,1g甲醇燃烧生成
和液态水时放热22.68KJ,下列热化学方程式正确的是( )
A.
,
B.
,
C.
,
D.
,
难度: 简单查看答案及解析
-
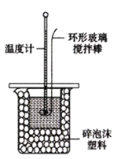
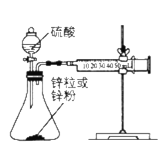
某同学设计如图所示实验,探究反应中的能量变化。
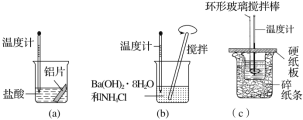
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定中和热的数值偏高
难度: 简单查看答案及解析
-
通过以下反应可获得新型能源二甲醚(
)。下列说法不正确的是
①
②
③
④
A.反应①、②为反应③提供原料气
B.反应③也是
资源化利用的方法之一
C.反应
的
D.反应
的
难度: 中等查看答案及解析
-
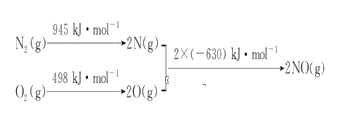
已知4NH3+5O2 = 4NO+6H2O,若化学反应速率分别
[单位:mol/(L·s)]表示,则正确关系是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
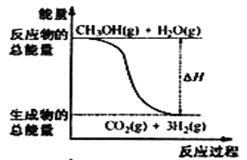
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
难度: 中等查看答案及解析
-
通常人们把拆开(或生成)1 mol 某化学键所吸收(或放出)的能量看成该化学键的键能。化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键
A—A
B—B
A—B
生成1mol化学键时放出的能量
436kJ/mol
243kJ/mol
431kJ/mol
则下列热化学方程式不正确的是
A.
A2(g)+
B2(g)=AB(g) ΔH=-91.5kJ/mol
B.A2(g)+B2(g)=2AB(g) ΔH=-183kJ/mol
C.
A2(g)+
B2(g)=AB(g) ΔH=+91.5kJ/mol
D.2AB(g)=A2(g)+B2(g) ΔH=+183kJ/mol
难度: 中等查看答案及解析
-
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
难度: 中等查看答案及解析
-
碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)═2H2O(l) △H= -571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H= -1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l) △H= -57.3kJ•mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6kJ•mol-1
B.
H2SO4(aq)+
Ba(OH)2(aq)═
BaSO4(s)+H2O(l) △H=-57.3kJ•mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l) △H=+131.4kJ•mol-1
难度: 中等查看答案及解析
-
反应A+B
C(ΔH < 0)分两步进行:①A+B
X(ΔH>0); ②X
C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
A.
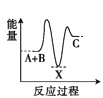
B.
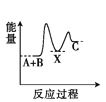
C.

D.
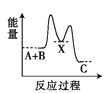
难度: 中等查看答案及解析
-
反应2A(s)+B(g)
2C(g)+D(g),经2minB的浓度减少0.6mol/L。下列有关说法正确的是( )
A.用A表示的反应速率是
B.分别用B、C、D表示反应的速率,其比是1∶2∶1
C.2min末时的反应速率用反应物B来表示的是
D.在2min内用B和C表示的反应速率的值是相同的
难度: 中等查看答案及解析
-
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
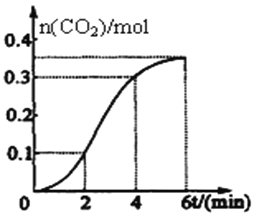
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
难度: 简单查看答案及解析
-
为探究
、
与盐酸(浓度为
)反应过程中的热效应,实验测得的数据如表所示:
序号
35mL试剂
固体
混合前温度/℃
混合后温度/℃
①
水
2.5g
20.0
18.5
②
水
3.2g
20.0
24.3
③
盐酸
2.5g
20.0
16.2
④
盐酸
3.2g
20.0
25.1
由此得出的结论正确的是( )
A.
固体与盐酸的反应是吸热反应
B.
固体与盐酸的反应是放热反应
C.20.0℃时,含3.2g
的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g
的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
难度: 中等查看答案及解析
-
体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)
NH3(g)+HBr(g),2HBr(g)
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1 B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1 D. 1.25 mol·L-1·min-1
难度: 困难查看答案及解析