-
化学与环境、生产、生活关系密切,下列说法不正确的是
A.生产防护口罩所需的熔喷布用的聚丙烯材料属于合成纤维
B.研究表明,新冠病毒可通过气溶胶传播。气溶胶的粒子大小在 1 nm~100 nm 之间
C.核酸是病毒的“身份证”,核酸水解的最终产物是磷酸、五碳糖和氨基酸
D.港珠澳大桥路面使用了沥青和混凝土,沥青可以通过石油分馏得到
难度: 简单查看答案及解析
-
医用酒精(75%乙醇)和84消毒液(主要成分是次氯酸钠)均能用于消毒。设NA为阿伏加德罗常数的值,下列说法正确的是
A.74.5g次氯酸钠中含有的分子数目为NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2 NA
C.46g医用酒精中含有碳碳键的数目为0.75 NA
D.1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA
难度: 中等查看答案及解析
-
在 2019 年第十届国际二次电池展中,一种以 Fe[Fe(CN)6]为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是
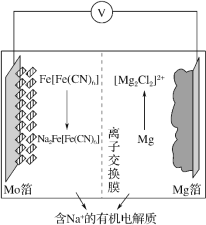
A.充电时,阴极反应式为 Fe[Fe(CN)6 ]+2Na++2e- =Na2Fe[Fe(CN)6 ]
B.充电时,Mg 箔接电源的正极
C.放电时,Na+通过离子交换膜从右室移向左室
D.放电时,外电路中通过 0.4mol 电子时,负极质量变化为 9.2g
难度: 中等查看答案及解析
-
短周期元素 X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、W 位于同族。Y 和 Z 的价电子数之和等于 R 和 T 的最外层电子数之和,这四种元素组成两种盐 Z2TY3 和 ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是
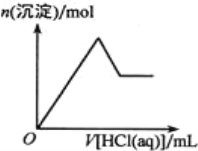
A.X、Y、Z 不可能同存在于一种离子化合物中
B.单质的熔点:Y < Z < T
C.简单离子的半径:r(Y)> r(W)> r(Z)
D.Z、R 分别与 Y 形成的化合物中都只含离子键
难度: 中等查看答案及解析
-
中成药连花清瘟胶囊中有效成分为绿原酸。已知绿原酸存在如图转化,下列有关说法正确的是
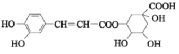 (绿原酸)
(绿原酸)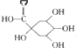 (化合物I) +
(化合物I) +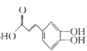 (化合物II)
(化合物II)A.在反应①中,绿原酸与水按 1∶1 发生反应,则绿原酸的分子式为C16H20O10
B.1 mol化合物Ⅰ与足量金属钠反应生成氢气体积为56L
C.绿原酸、化合物I、化合物II均能发生氧化反应、取代反应、消去反应
D.化合物II中所有碳原子可能都共面
难度: 简单查看答案及解析
-
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中
变化的曲线如图所示。
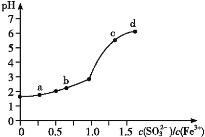
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液
B.c点和d点出现上述现象的主要原因是Fe3+和
发生双水解反应
C.b点较a点溶液pH升高的主要原因:2Fe3++
+H2O = 2Fe2++
+2H+
D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+
难度: 困难查看答案及解析
-
25℃时,在 20 mL 0.1 mol•L-1 一元弱酸HA溶液中滴加0. 1mol• L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与 pH 关系如图所示。下列说法正确的是

A.A点对应溶液中:c(OH-)>c(H+)
B.25℃时,HA电离常数的数量级为10-5
C.B点对应的 NaOH 溶液体积小于 10 mL
D.对C点溶液加热(不考虑挥发),则
增大
难度: 困难查看答案及解析
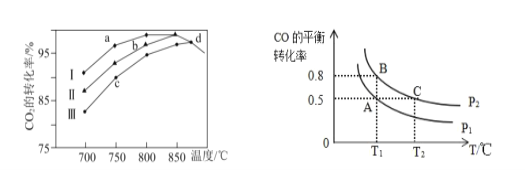
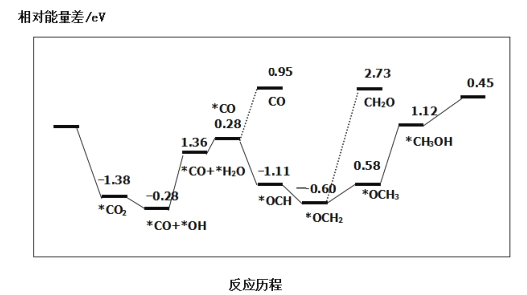
 B.
B.  C.
C.  D .
D .
 b.
b.  c.
c. 

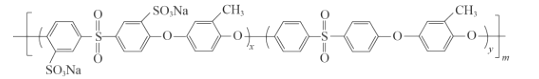
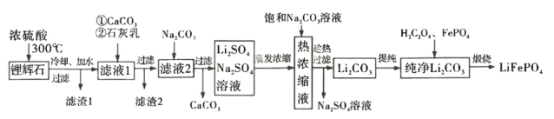
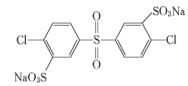 、________、________。
、________、________。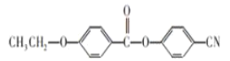 的合成路线流程图(无机试剂任用)__
的合成路线流程图(无机试剂任用)__