-
2019年10月1日,我国成功举办国庆七十周年阅兵活动。其中阅兵仪式上混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(ii)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)制备合成气:工业生产中为解决合成气中H2过量而 CO 不足的问题,原料气中需添加CO2,发生的反应(iii):CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH= +41.17kJ•mol-1,为了使合成气配比最佳,理论上原料气中二氧化碳与甲烷质量比为 _______。
(2)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①请写出二氧化碳加氢合成水蒸气和甲醇的热化学方程式____________。
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示:
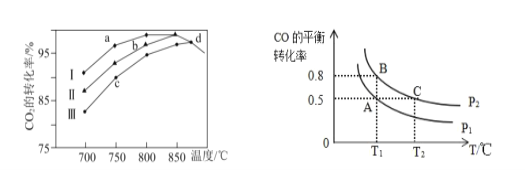
a~d 点中反应一定处于平衡状态的点是____;CO2的转化率 a 点比 c 点高的原因是 ____。
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:
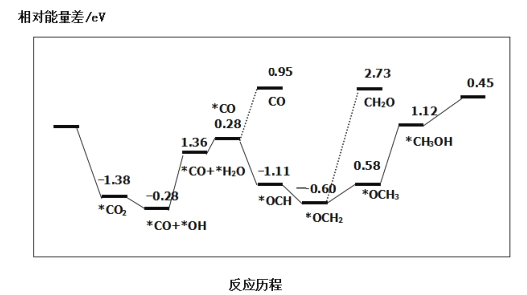
容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为___;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中____(填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3D.*OCH3→*CH3OH
(3)在一容积可变的密闭容器中充入10molCO和20molH2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①比较A、B 两点压强大小PA_______PB填“>、<、 =”)
②若达到化学平衡状态 A 时,容器的体积为 10 L,如果反应开始时仍充入 10molCO和20molH2,则在平衡状态 B 时,容器的体积V(B)=_______L;
-
2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。
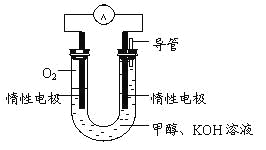
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
-
2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为___。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。
(3)实验室常用KSCN溶液、苯酚( )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
(4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为___。
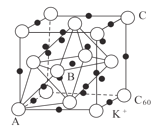
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
-
2019年10月1曰,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态Cr原子的价电子排布式为___。
(2)实验室常用KSCN溶液、苯酚( )检验Fe3+。
)检验Fe3+。
①第一电离能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ数目为___。
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
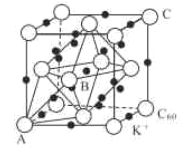
(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___,晶胞参数为428pm,则晶体密度为___g•cm-3(NA表示阿伏加德罗常数的值,列出表达式)。
-
2019年10月1曰,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态Cr原子的价电子排布式为___。
(2)实验室常用KSCN溶液、苯酚( )检验Fe3+。
)检验Fe3+。
①第一电离能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ数目为___。
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
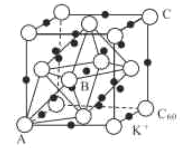
(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___,晶胞参数为428pm,则晶体密度为___g•cm-3(NA表示阿伏加德罗常数的值,列出表达式)。
-
2009年10月1日,在天安门广场举行了隆重的国庆阅兵仪式,展现了我国强大的综合国力,其中坦克的展示无疑是一个巨大的亮点。坦克的制造材料主要是各种金属的合金,钢铁便是其中十分重要的一种。下列关于铁的说法中,正确的是
A.铁元素属于过渡元素,其原子序数为26
B.单质铁与浓硫酸在常温下不反应
C.铁单质只具有还原性,其阳离子只具有氧化性
D.与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
-
2009年10月1日,在天安门广场举行了隆重的国庆阅兵仪式,展现了我国强大的综合国力,其中坦克的展示无疑是一个巨大的亮点.坦克的制造材料主要是各种金属的合金,铁便是其中十分重要的一种.下列关于铁的说法中正确的是( )
A.铁单质只具有还原性,其阳离子只具有氧化性
B.常温下,单质铁与浓硫酸不反应
C.铁元素属于过渡元素,其原子序数为26
D.比较与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快
-
在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
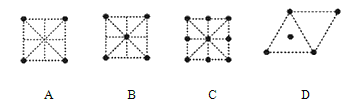
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A.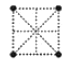 B.
B.  C.
C.  D .
D .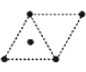
a. 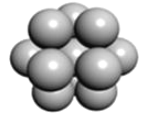 b.
b. 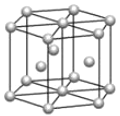 c.
c. 
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g•cm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
-
在国庆阅兵式上,展示了我国研制的各种导弹。导弹之所以有神奇的命中率,是制导弹合金材料中的稀土元素钕(60Nd)的贡献。下列说法正确的是( )
A. Nd、
Nd、 Nd 和
Nd 和 Nd 互为同素异形体
Nd 互为同素异形体
B. Nd 、
Nd 、 Nd 和
Nd 和 Nd 的化学性质不同
Nd 的化学性质不同
C. Nd 原子中含有60个质子和142个中子
Nd 原子中含有60个质子和142个中子
D. Nd、
Nd、 Nd和
Nd和 Nd都是钕元素的不同核素
Nd都是钕元素的不同核素
-
庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____,S 的_____杂化轨道与 O 的 2p 轨道形成_____键(填 “π”或“σ”)。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____(填字母序号)。
(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。
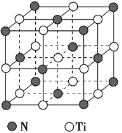
若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____(用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____。






 B.
B.  C.
C.  D .
D .
 b.
b.  c.
c. 

