-
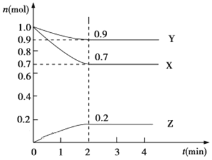
对于反应2A+B⇌C+D表示反应速率最快的是
A.vA=0.75mol/(L·s) B.vB=0.5mol/(L·s) C.vC=1.0mol/(L·s) D.vD=1.5mol/(L·s)
难度: 简单查看答案及解析
-
下列燃烧反应的反应热是燃烧热的是:
A.H2(g)+1/2 O2(g)=H2O(g) △H1 B.C(s)+1/2 O2(g)=CO(g) △H2
C.S(s)+O2(g)=SO2(g) △H3 D.H2S(g)+1/2O2=S(s)+H2O(l) △H4
难度: 简单查看答案及解析
-
下列物质在水溶液中促进了水的电离的是
A.NaHSO4 B.HClO C.NaCl D.CuSO4
难度: 简单查看答案及解析
-
对于反应2H2 (g)+O2 (g)
2H2O (g),能增大正反应速率的措施是
A. 增大O2 的物质的量浓度 B. 增大反应容积
C. 移去部分H2O (g) D. 降低体系温度
难度: 简单查看答案及解析
-
下列各装置能形成原电池的是( )
A.
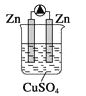 B.
B.  C.
C. 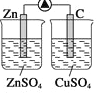 D.
D. 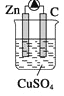
难度: 简单查看答案及解析
-
下列物质属于强电解质的是
A.盐酸 B.氟化氢 C.熔融氯化钠 D.铜
难度: 简单查看答案及解析
-
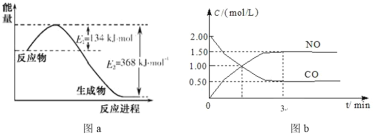
由 N2O 和 NO 反应生成 N2 和 NO2 的能量变化如图所示。下列说法不正确的是
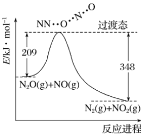
A.反应生成 1 mol N2 时转移 2 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和大于成键释放能量之和
难度: 中等查看答案及解析
-
在某温度下,反应 ClF(g)+F2(g)⇌ClF3(g) ΔH=+268 kJ·mol-1,在密闭容器中达到平衡,下列说法中正确的是
A.升高温度,K不变,平衡向正反应方向移动
B.升高温度,平衡常数变小
C.升高温度,平衡向正反应方向移动,F2 的转化率提高
D.降低温度,单位时间内生成 ClF3 的物质的量增加
难度: 中等查看答案及解析
-
多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
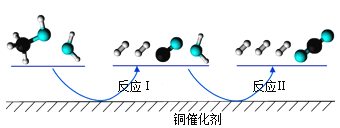

下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
难度: 简单查看答案及解析
-
对于工业合成氨反应:N2+3H2
2NH3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率 B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100℅ D.增大N2浓度可以增大反应速率
难度: 简单查看答案及解析
-
某小组依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示,下列说法正确的是
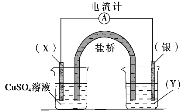
A.电极X可以是碳棒也可以是银棒
B.盐桥中的阳离子流向CuSO4溶液所在烧杯
C.银电极为电池的负极,发生的电极反应为Ag-e-=Ag+
D.外电路中电流的方向是从银电极流向X电极
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.将纯水加热的过程中,Kw变大、pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol·L-1氨水中加入少量水,pH减小,
减小
难度: 中等查看答案及解析
-
在密闭容器中进行反应CH4(g)+H2O(g)
CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
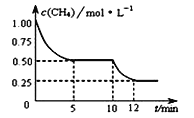
A.10 min时,改变的外界条件可能是升高温度
B.反应进行到12min时,CH4的转化率为25%
C.0∽5 min内,v(H2)=0.1 mol·(L·min)-1
D.恒温下,缩小容器体积,平衡后H2浓度减小
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.H+、Na+、Cl-、
B.Na+、
、H+、S2-
C.Na+、H+、
、
D.Fe2+、Na+、
、Cl-
难度: 中等查看答案及解析
-
已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,关于 NaHC2O4 溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(
)>c(
)>c(H2C2O4)
B.c(Na+)=c(
)+c(
)+c(H2C2O4)
C.c(Na+)+c(H+)=c(
)+c(
)+c(OH-)
D.c(H+)+c(H2C2O4)=c(
)+c(OH-)
难度: 中等查看答案及解析
-
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
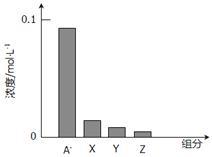
A.HA是强酸
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析
-
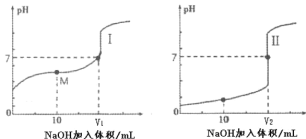
现有室温下四种溶液,有关叙述不正确的是
编号
①
②
③
④
pH
10
10
4
4
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A.相同体积③、④溶液分别与 NaOH 完全反应,消耗 NaOH 物质的量:③>④
B.分别加水稀释 10 倍,四种溶液的 pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中 c(
)>c(Cl-)>c(OH-)>c(H+)
D.在③溶液中:c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-)
难度: 中等查看答案及解析
-
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A
B
C
D
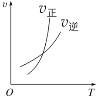
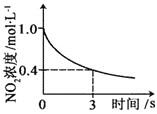
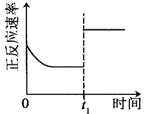
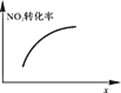
升高温度,正反应方向平衡常数减小
0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1
t1时仅加入催化剂,平衡正向移动
达平衡时,仅改变x,则x为c(O2)
A. A B. B C. C D. D
难度: 困难查看答案及解析