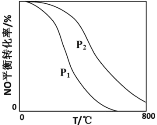
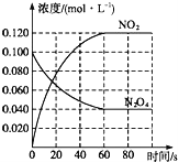
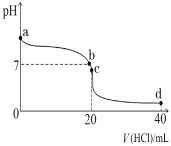
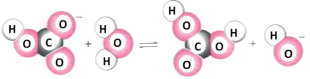
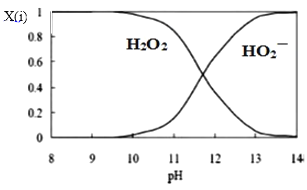
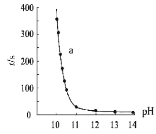
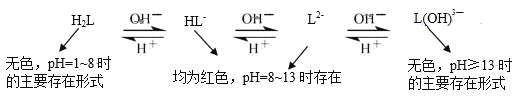
-
关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 中等查看答案及解析
-
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS、CdS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2+ + S2-= CuS↓
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
对于反应3A(g)+B(g)
2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.9 mol·L-1·min-1 B.v(B)=0.2mol·L-1·min-1
C.v(C)=0.5mol·L-1·min-1 D.v(D)=1.0mol·L-1·min-1
难度: 简单查看答案及解析
-
下列化学变化中,属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl晶体的反应
C.乙炔在空气中燃烧
D.NaOH与醋酸的反应
难度: 简单查看答案及解析
-
下列措施中,一定能使化学平衡移动的是( )
A.改变温度 B.改变压强 C.使用催化剂 D.改变容器体积
难度: 简单查看答案及解析
-
下列物质中,属于弱电解质的是
A. H2O B. Na2CO3 C. HCl D. NaCl
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是( )
A.H+、Na+、CO32- B.Cl-、Ba2+、SO42-
C.H+、OH-、SO42- D.H+、Ag+、NO3-
难度: 简单查看答案及解析
-
常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是:①盐酸、②氯化铵溶液、③硝酸钠溶液、④氢氧化钠溶液中的( )
A. ①④ B. ①② C. ②③ D. ③④
难度: 中等查看答案及解析
-
下列关于电解池的叙述中,不正确的是( )
A.在电解池的阳极发生氧化反应
B.与电源正极相连的是电解池的阴极
C.与电源负极相连的是电解池的阴极
D.电子从电源的负极沿导线流入电解池的阴极
难度: 简单查看答案及解析
-
物质的量浓度相同的下列溶液中,
浓度最大的是
A.(NH4)2SO4 B.(NH4)2CO3 C.(NH4)2SO3 D.(NH4)2Fe(SO4)2
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
难度: 中等查看答案及解析
-
有关如图所示原电池的叙述,正确的是( )(盐桥中装有含KCl饱和溶液的琼脂)
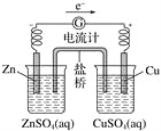
A.该原电池工作时,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计的指针依然保持偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
难度: 中等查看答案及解析
-
在1 L恒定容积的密闭容器中,可以证明可逆反应N2(g)+3H2(g)
2NH3(g)已达到平衡状态的是( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.一个N≡N键断裂的同时,有3个H—H键生成
C.其他条件不变时,混合气体的密度不再改变
D.v正(N2)=2v逆(NH3)
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
难度: 中等查看答案及解析
-
为了除去氯化镁酸性溶液中的铁离子,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A.一水合氨 B.烧碱 C.碳酸镁 D.碳酸钠
难度: 困难查看答案及解析
-
室温下,关于1.0mL0.1mol/L氨水。下列判断正确的是
A.溶液的pH等于13
B.加入少量NH4Cl固体,c (OH-)不变
C.c(OH-)=c (
)+c(H+)
D.与1.0mL0.1mol/L盐酸混合后,溶液呈中性
难度: 简单查看答案及解析
-
下列实验操作及现象与推论不相符的是
选项
操作及现象
推论
A
用pH试纸测得0.1 mol/L CH3COOH溶液pH约为3
CH3COOH是弱电解质
B
向某无色溶液中加入足量稀盐酸,产生无色无味气体;再将该气体通入澄清石灰水,产生白色浑浊
溶液中可能含有CO32-或HCO3-
C
用pH计测定相同浓度的CH3COONa溶液和NaClO溶液的pH,前者的pH小于后者的
HClO的酸性弱于CH3COOH
D
向2 mL 1 mol/L NaOH溶液中加入1 mL 0.1 mol/L MgCl2溶液,产生白色沉淀;再加入1 mL 0.1 mol/L FeCl3溶液,沉淀变为红褐色
Mg(OH)2沉淀转化为Fe(OH)3沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是( )
A.负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑
B.正极的电极反应式是O2+4H++4e-=2H2O
C.溶液中阴离子向正极移动
D.放电后电解质溶液的碱性增强
难度: 中等查看答案及解析
-
实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
难度: 中等查看答案及解析