-
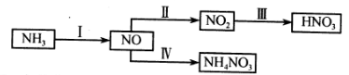
某氮肥厂用NH3经一系列反应制得HNO3。NH3→NO→NO2→HNO3。
(1)25℃时,NH3和O2能反应生成NO和液态水,生成6mol水时放热1289kJ,其热化学方程式是_____。
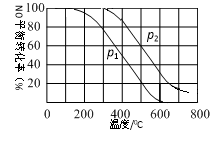
(2)对于反应2NO(g)+O2(g) 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
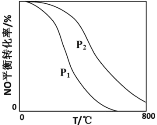
请比较P1、P2的大小:P1____P2(填“>”、“=”或“<”);该反应△H____0(填“>”、“=”或“<”)。
(3)四氧化二氮和二氧化氮可互相转化。在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
①该反应的△H_____0(填“>”、“=”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____mol·L-1·s-1,该温度下反应的平衡常数K=_____。
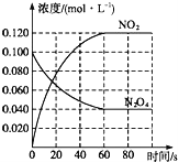
②反应达平衡后,将反应容器的容积缩小到原来的一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)25℃时,将0.1mol·L-1盐酸滴入20mL0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
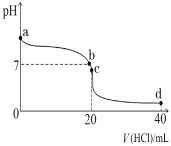
①写出NH3·H2O的电离方程式:_____。
②b点所示溶液中c(Cl-)_____c(NH )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
③c点所示溶液中,离子浓度由大到小的顺序是_____。
-
NH3经一系列反应可以得到HNO3,如下图所示。
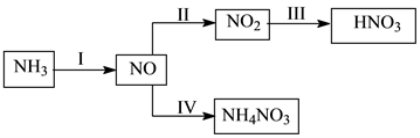
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是____________。
(2)II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。
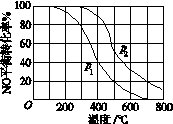
①比较P1、P2的大小关系:P1______P2(用“>”、“<”、“=”)
②随温度升高,该反应平衡常数变化的趋势是________。
(3)III中,将NO2、O2、H2O化合制硝酸的化学方程式_______。
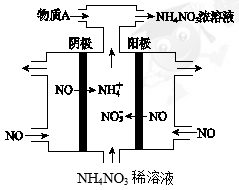
(4)IV中,电解NO制备 NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。
-
(10分)NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
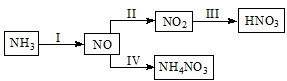
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是 。
(2)II中,2NO(g)+O2(g)  2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
①比较p1、p2的大小关系 。
②在温度为500℃、压强为p2条件下,平衡混合气中NO2的体积分数 。
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)  N2O4(l) ΔH2
N2O4(l) ΔH2
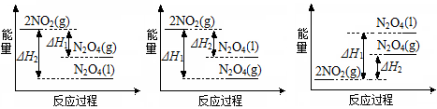
A B C
反应过程中能量变化正确的是 (填序号)。
②N2O4与O2、H2O化合的化学方程式 。
-
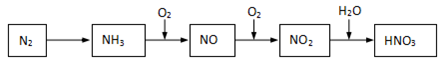
游离态的氮经一系列转化可以得到硝酸,如下图所示。

(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
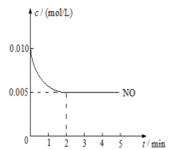
(3)2NO(g)+O2(g)  2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
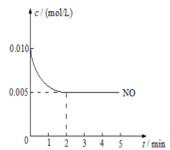
①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.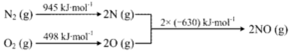
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
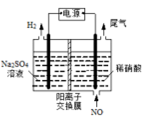
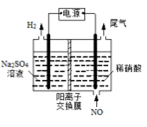
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。
-
游离态的氮经一系列转化可以得到硝酸,如下图所示。
(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g)  2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.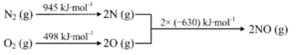
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。
-
仅用下图装置可完成
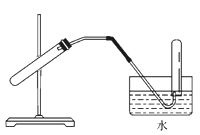
A.浓硫酸和铜制SO2
B.用Cu与浓HNO3反应制NO2
C.用 NH4CI 与 Ca(OH)反应制 NH3
D.用锌粒与稀H2SO4反应制H2
-
(14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
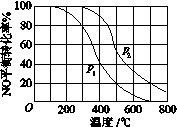
①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
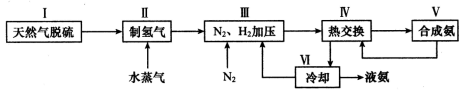
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206.4 kJ/mol
CO(g)+3H2(g) △H = +206.4 kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2 kJ/mol
CO2(g)+H2(g) △H = —41.2 kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
-
下列叙述不正确的是( )
A.NH3易液化,液氨常用作制冷剂
B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.稀HNO3和活泼金属反应时得不到氢气
-
下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C.铵盐受热易分解,因此贮存氮肥时要密封保存,并放在阴凉通风处
D.不能用稀HNO3和金属反应制取氢气
-
下列指定反应的离子方程式正确的是( )
A. Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。

2NO2(g),随温度升高,混合气体的颜色变深。


)(填“>”、“=”或“<”)。