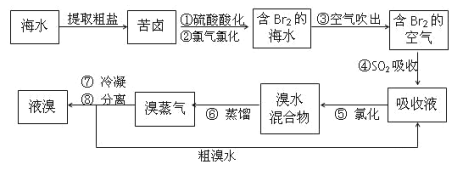
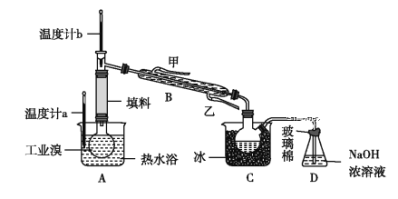
-
下列说法不正确的是
A. 碘单质的升华过程中,只需克服分子间作用力
B. BaCl2属于离子化合物,该晶体中只存在离子键
C. 化学键的断裂与形成一定伴随着电子的转移和能量变化
D. NaHSO4和NaHCO3两种晶体溶于水时,被破坏的作用既有离子键又有共价键
难度: 中等查看答案及解析
-
下列说法与“绿水青山就是金山银山”的绿色发展理念不一致的是
A.将工业废液排入海洋以减少河道污染
B.推广煤的液化、气化技术以提高煤的使用效率
C.利用CO2制成全降解塑料可缓解日益严重的“白色污染”
D.采用催化转化技术可将汽车尾气中的NOx和CO转化为无毒气体
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是
A. 35Cl−和37Cl−离子结构示意图均可以表示为:
B. HClO的结构式:H−Cl−O
C. HF的电子式:
D. 质子数为92、中子数为146的U原子:
难度: 简单查看答案及解析
-
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列化工生产原理错误的是( )
①可以电解熔融的氯化钠来制取金属钠;②可以将钠加入氯化镁饱和溶液中制取镁;
③用电解法冶炼铝时,原料是氯化铝;④高炉炼铁的反应是放热的,故无需加热.
A.②③ B.①③ C.①②③ D.②③④
难度: 简单查看答案及解析
-
某气态烃1体积只能与1体积HBr发生加成反应,生成溴代烷,此溴代烷1mol可与7mol Cl2发生完全取代反应,则该烃的结构简式为
A.CH2=CH2 B.CH3CH=CH2
C.CH3CH3 D.CH2=CH—CH=CH2
难度: 中等查看答案及解析
-
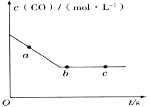
煤的气化是煤高效、洁净利用的方向之一。如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图。由图可知该煤气中

A.只含有碳、氢两种元素
B.所含的有机物是CH4、CnHm
C.CO体积分数大于CH4体积分数
D.低温有助于提高H2的含量
难度: 中等查看答案及解析
-
莽草酸可用于合成药物达菲,莽草酸的结构简式如图所示。下列关于莽草酸的说法正确的是( )
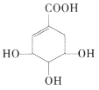
A.分子式为
B.分子中含有2种官能团
C.可发生加成反应和取代反应 D.1mol莽草酸与足量的Na反应,标况下生成33.6LH2
难度: 中等查看答案及解析
-
“绿色化学”对化学反应提出了“原子经济”的新概念及要求,理想原子经济反应是原料中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是( )
①取代反应 ②加成反应 ③氧化反应 ④加聚反应 ⑤酯化反应
A.①② B.①④ C.②④ D.③⑤
难度: 简单查看答案及解析
-
有机物A分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是( )
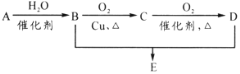
A.75%(体积比)的B溶液常用于医疗消毒
B.D、E都能与NaOH溶液反应
C.由B、D制备E常用浓硫酸作脱水剂
D.B、D、E三种物质可以用饱和Na2CO3溶液鉴别
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
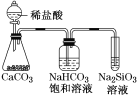
D.用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
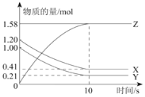
A.反应的化学方程式为: X(g)+Y(g)
Z(g)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.温度、体积不变,10s时充入1 mol He使压强增大,正、逆反应速率都增大
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.往蔗糖液中加入稀硫酸,水浴加热,充分反应后加入新制氢氧化铜悬浊液,加热,可见有砖红色沉淀生成;
B.冰醋酸、淀粉、纤维素都是纯净物
C.要萃取溴水中的溴单质,可以选用苯、CCl4或酒精做萃取剂
D.用试管取出少量淀粉水解液,加入碘水,若不显蓝色,说明淀粉水解完全
难度: 简单查看答案及解析
-
化学反应A2+B2 = 2AB的能量变化如图所示,则下列说法正确的是

A.该反应是吸热反应
B.断裂 1molA-A 键和 1molB-B 键能放出xkJ 的能量
C.2mol AB 的总能量高于1mol A2和1mol B2和的总能量
D.断裂 2mol A-B 键需要吸收ykJ 的能量
难度: 简单查看答案及解析
-
将1 mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述不正确的是( )
A.产物的平均摩尔质量为24 g/mol
B.反应中消耗的氧气为56 g
C.若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的三分之一
D.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O
3H2+CO,每消耗1mol CH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电极B上发生的电极反应为:O2+2CO2+4e-=2
D.电池工作时,
向电极B移动
难度: 中等查看答案及解析