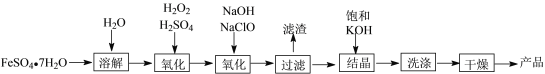
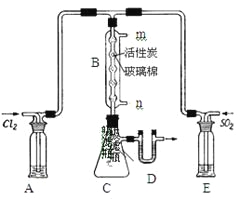
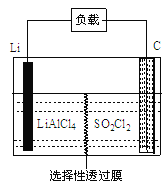
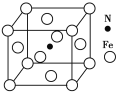
-
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.绿色化学的核心是利用化学原理治理环境污染
C.分馏法提炼汽油
D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.CH2F2的电子式:
B.羟基的电子式:
C.对硝基甲苯的结构简式:
D.异丙醇的结构简式:CH3CH2CH2OH
难度: 中等查看答案及解析
-
下列有关工业生产叙述正确的是
A.电解精炼铜时,将粗铜与电源的负极相连
B.合成氨工业中,将NH3及时液化分离有利于加快反应速率
C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高
D.工业上通常使用电解法制备金属钠、镁、铝等
难度: 简单查看答案及解析
-
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO
C.使甲基橙变红色的溶液中:Fe2+、K+、NO
、SO
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH
、SO
、HCO
、Cl-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA
B.1 mol氯气和足量NaOH溶液反应转移的电子数目为2NA
C.常温下,9.2 g NO2和N2O4的混合气体中含有的氮原子数目为0.2 NA
D.标准状况下,22.4 L甲苯中含C-H数目为8 NA
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①
②
③
④
⑤
A.①⑤ B.②③ C.②⑤ D.③④
难度: 困难查看答案及解析
-
下列离子方程式中,正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+H2O
2OH-+Cl2↑+H2↑
B.碳酸钠溶液显碱性:CO32-+H2O
HCO3-+OH-
C.氯气通入冷水中:Cl2 +H2O
Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
下列装置进行相应的实验,能达到实验目的的是
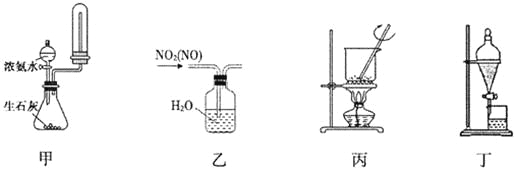
A.用装置甲制取并收集干燥纯净的NH3
B.用装置乙除去NO2中的少量NO
C.用装置丙将海带灼烧成灰
D.用装置丁分离乙酸乙酯和饱和碳酸钠溶液
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。Y是地壳中含量最高的元素,X、Y原子的最外层电子数之比为2:3,Z是短周期中金属性最强的元素,W原子与X原子的最外层电子数相同。下列说法正确的是
A.原子半径:r(Y)<r(X)<r(W)<r(Z) B.X的非金属性比Y的强
C.W的简单气态氢化物的热稳定性比X的强 D.Z位于元素周期表中第2周期ⅠA族
难度: 中等查看答案及解析
-
下列说法正确的是
A.在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿
B.常温下,将pH= 4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小
难度: 中等查看答案及解析
-
W、X、Y、Z、T均为短周期元素,X、Y、T原子最外层电子数之和为18。下列说法正确的是
A.X、Y、T三种元素最低价氢化物的沸点依次升高
B.X、Y和氢三种元素可共同形成离子化合物或共价化合物
C.物质WY2、ZY2一定都有熔点高、硬度大的特性
D.元素X、Y、T的最高正价的顺序为:T>Y>X
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结 论
A
用铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中无K+
B
向溶液中先滴加稀盐酸,再滴加BaCl2溶液
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀
溶液中一定含有SO42-
C
向一定浓度的CuSO4溶液中通入适量H2S气体
出现黑色沉淀
H2S的酸性比H2SO4强
D
向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析