-
《现代汉语词典》中有:“纤维”是细丝状物质或结构。下列关于“纤维”的说法不正确的是( )
A.造纸术是中国古代四大发明之一,所用到的原料木材纤维属于糖类
B.丝绸是连接东西方文明的纽带,其中蚕丝纤维的主要成分是蛋白质
C.光纤高速信息公路快速发展,光导纤维的主要成分是二氧化硅
D.我国正大力研究碳纤维材料,碳纤维属于天然纤维
难度: 中等查看答案及解析
-
有机化合物在食品、药物、材料等领域发挥着举足轻重的作用。下列说法正确的是( )
A. 2﹣丁烯分子中的四个碳原子在同一直线上
B. 按系统命名法,化合物(CH3)2C(OH)C(CH3)3的名称为2,2,3﹣三甲基﹣3﹣丁醇
C. 甲苯和间二甲苯的一溴代物均有4种
D. 乙酸甲酯分子在核磁共振氢谱中只能出现一组峰
难度: 中等查看答案及解析
-
下列关于物质结构的说法错误的是( )
A.在H2O和NH3分子中的键角:H—O—H > H—N—H
B.晶格能:NaF>NaCl>NaBr
C.基态碳原子有三种能量不同的电子
D.CH4和NH4+都是正四面体结构,键角均为109°28'
难度: 简单查看答案及解析
-
捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
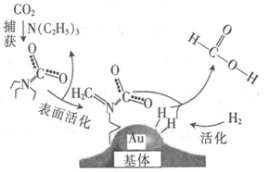
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
难度: 中等查看答案及解析
-
已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质 M3XY(可视为M2X • MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY:2M +2MXA + 2MY==2M3XY + A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是( )
A.X位于第二周期第IVA族
B.简单离子半径:Y > M > X
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
难度: 中等查看答案及解析
-
有机物X的结构简式如图所示。下列说法错误的是( )
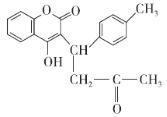
A.有机物X的分子式为C20H18O4
B.1 mol有机物X最多可以和8 mol H2加成
C.1 mol有机物X最多消耗2 mol NaOH
D.分子中没有手性碳
难度: 简单查看答案及解析
-
下列实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
证明溴乙烷发生消去反应,生成了乙烯
将溴乙烷与NaOH的乙醇溶液混合后加热,产生的气体直接通入酸性KMnO4溶液中,溶液褪色
B
证明酸性条件下,氧化性:H2O2 >Fe3+
向Fe(NO3)2溶液中滴加用硫酸酸化的H2O2溶液,溶液变黄色
C
利用强酸制弱酸的原理制备次氯酸
将等体积、等浓度的亚硫酸和次氯酸钙溶液混合,过滤取清液
D
证明AgI的Ksp小于AgCl的Ksp
向两份相同的AgNO3溶液中分别滴加2滴等浓度的NaCl溶液和NaI溶液,一 份中产生黄色沉淀,另一份无明显现象
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
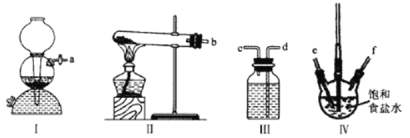
A.实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中
B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置Ⅳ内会出现浑浊现象
难度: 简单查看答案及解析
-
近日,我国科学家实现了CO2的捕获与转化,装置如图所示,利用其能吸收二氧化碳,并产生有价值的物质,该设计在国际期刊《JournalofEnergyChemistry》中发表。下列有关说法正确的是( )

A.电源在使用过程中,b极发生还原反应
B.该装置实现了CO2的化学能转化为电能
C.利用该装置的原理,理论上也可用于捕获与转化硫氧化物、氮氧化物
D.若电源中有4mol电子转移,则最多可捕获CO222.4L
难度: 简单查看答案及解析
-
某固体粉末由NaCl、NaBr、(NH4)2CO3、Na2SO3、Na2SO4中的一种或几种组成,取该固体粉末wg进行如下实验(所加试剂均足量): ( )

根据实验结果,下列有关说法正确的是( )
A.原固体粉末中含有NaCl
B.若溶液1中只加BaCl2溶液,则生成的白色沉淀1的质量小于或等于a g
C.原固体粉末中必含有(NH4 )2CO3、Na2SO3
D.测定出白色沉淀3的质量可以确定原固体粉末的组成
难度: 困难查看答案及解析
-
某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程如图所示(图中只画出了 HAP的部分结构,用18O标记羟基磷灰石中的羟基氧原子)。下列说法正确的是( )
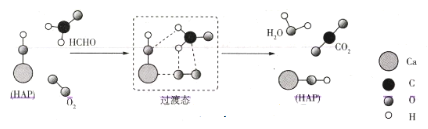
A.反应物的键能之和大于生成物的键能之和
B.HAP改变了该反应的历程和焓变,加快了反应速率
C.经过该催化氧化过程后18O仍然在HAP中
D.反应过程中,碳原子由sp2杂化变为sp杂化
难度: 困难查看答案及解析
-
常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是( )

A.a点对应的溶液中Ca2+开始形成沉淀,且溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.如图可以说明CaCO3在溶液中存在过饱和现象
D.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
难度: 困难查看答案及解析
-
图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )
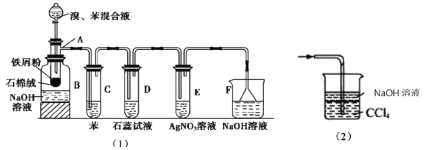
A.苯和液溴在A中发生的反应为取代反应
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
难度: 简单查看答案及解析
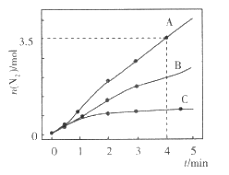
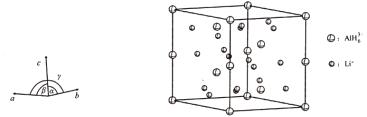

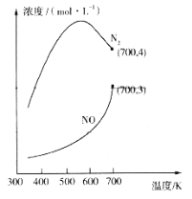

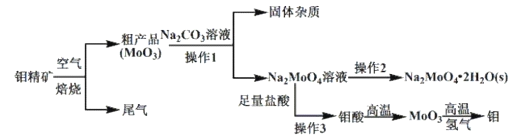
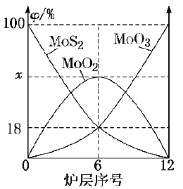
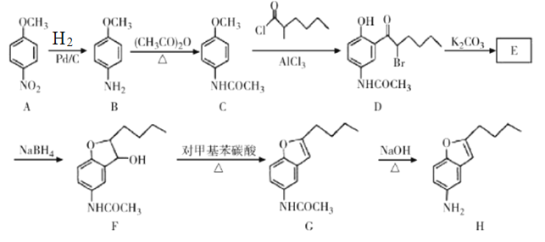
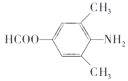 ,下列说法正确的是________。
,下列说法正确的是________。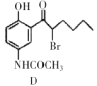 中手性碳原子个数为____________。
中手性碳原子个数为____________。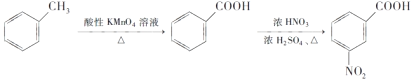
 ,写出制备的合成路线流程图(无机试剂任选)______________。
,写出制备的合成路线流程图(无机试剂任选)______________。