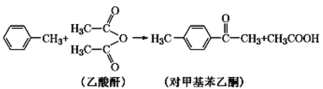
-
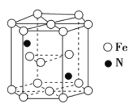
下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A. 氯化钠与蔗糖熔化 B. 碘和干冰升华
C. 镁和硫熔化 D. 金刚石与氧化钠熔化
难度: 中等查看答案及解析
-
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
A. 三氯化硼液态时能导电而固态时不导电 B. 三氯化硼加到水中使溶液的pH升高
C. 三氯化硼分子呈平面三角形,属非极性分子 D. 分子中所有原子都满足最外层8电子稳定结构
难度: 中等查看答案及解析
-
①PH3的分子构型为三角锥形,②BeCl2的分子构型为直线形,③CH4分子的构型为正四面体形,④CO2为直线形分子,⑤BF3分子构型为平面正三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是
A.①⑥为极性分子,②③④⑤为非极性分子
B.只有④为非极性分子,其余为极性分子
C.只有②⑤是极性分子,其余为非极性分子
D.只有①③是非极性分子,其余是极性分子
难度: 中等查看答案及解析
-
某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.配合物中中心原子的电荷数为6
B.该配合物可能是平面正方形结构
C.Cl﹣和NH3分子均与中心铂离子形成配位键
D.该配合物的配体只有NH3
难度: 中等查看答案及解析
-
下列各组物质中均存在离子键、极性键和配位键的是
A.氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠
B.硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵
C.硫酸、氢氧化钠、氮化钙、氢氧化钡
D.氯化铵、氢氧化钠、双氧水、过氧化钙
难度: 简单查看答案及解析
-
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子一般能量最高 B.电离能最小的电子能量最高
C.在离核最近区域内运动的电子能量最低 D.p轨道电子能量一定高于s轨道电子能量
难度: 简单查看答案及解析
-
下列元素性质的递变规律正确的是
A.第一电离能:B<Be<Mg<Na
B.元素的电负性:O>N>S>P
C.气态氢化物的稳定性:NH3<CH4<PH3<SiH4
D.原子半径:Be<B<C<N
难度: 中等查看答案及解析
-
Fe为过渡金属元素,在工业生产中具有重要的用途。已知NO能被FeSO4溶液吸收生成配合物 [Fe(NO)(H2O)n]SO4,该配合物的中心离子的最外层电子数与配体提供的电子总数之和为26。下列有关说法正确的是( )
A.该配合物的化学式为[Fe(NO)(H2O)5]SO4
B.该配合物中所含非金属元素均位于元素周期表p区
C.1 mol该配合物与足量Ba(OH)2溶液反应可生成2 mol沉淀
D.该配合物中阳离子呈正八面体结构,阴离子呈正四面体结构
难度: 中等查看答案及解析
-
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
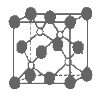
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
难度: 中等查看答案及解析
-
下列现象与氢键有关的有几项( )
①H2O的熔沸点比同族元素氢化物的高 ②小分子的醇可以和水以任意比互溶③冰的密度比液态水的密度小 ④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑤HF分解时吸收的热量比HCl分解时吸收的热量多
A.5项 B.4项 C.3项 D.2项
难度: 中等查看答案及解析
-
有关晶体的叙述中正确的是( )
A.在SiO2晶体中,最小的单元环是由6个硅原子组成的六元环
B.在124g白磷(P4)晶体中,含P—P共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C—C键键能小于Si—Si键
D.28g晶体Si中含Si原子与Si—Si键之比为1:2
难度: 中等查看答案及解析
-
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2−+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如图所示,下列说法不正确的是( )
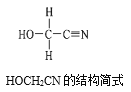
A.HOCH2CN分子中没有手性碳原子
B.1mol HOCH2CN分子中含有σ键的物质的量为5mol
C.[Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D.HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
难度: 中等查看答案及解析
-
下列分子或离子价层电子对互斥模型与分子或离子空间构型不一致的是( )
A.
B.
C.SO2 D.CCl4
难度: 中等查看答案及解析
-
As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
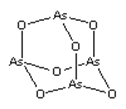
A.As2O3 分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定 B.氯化钠熔化时离子键未被破坏
C.冰熔化时水分子中共价键发生断裂 D.原子晶体中共价键越强,熔点越高
难度: 简单查看答案及解析
-
有4种元素X、Y、Z、Q,X原子M层上有2个未成对电子且无空轨道;Y3+的价电子排布式为3d5;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子。下列叙述不正确的是( )
A.X和Q结合生成的化合物为离子化合物 B.Z的单质形成的晶体可能是分子晶体
C.元素Y和Q可形成化合物Y2Q3 D.ZQ2是极性键构成的非极性分子
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 含W的盐溶液可能呈碱性
D. 简单离子半径:X<Y<Z<W
难度: 中等查看答案及解析
-
一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是
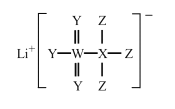
A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
难度: 困难查看答案及解析