-
钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
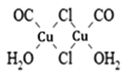
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
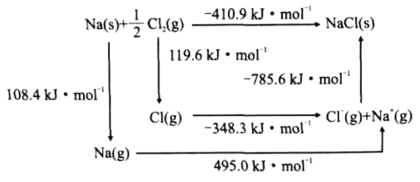
a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
-
钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
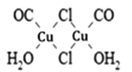
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。

a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
-
钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是_______,其价电子排布式为______。
(2)第四电离能大小:I4(Fe)> I4(Co),从原子结构的角度分析可能的原因是____。
(3)取1mol配合物CoCl3·6NH3(黄色)溶于水,加入足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为_______。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式_____;生成气体分子的中心原子杂化方式为____。
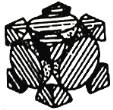
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为______(列出表达式并写出最终结果)。
-
镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
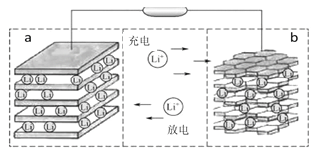
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阴极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
-
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Ni、Si、P等元素)制备,回答下面问题:
(1)钴元素在元素周期表中的位置____。 与硫元素位于同一主族,其价层电子排布式是___。
与硫元素位于同一主族,其价层电子排布式是___。
(2)MnSO4中阴离子的空间构型是____中心原子的杂化类型______。
(3)比较H2S ______H2Se热稳定性:(填“>”“<”)判断依据是______;比较沸点:N2H4 _____P2H4 (填“>”“<”),判断依据是______。
(4) FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,画出其结构并标出配位键__________。
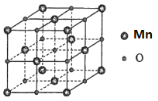
(5)MnO具有NaCl型结构(如图),其中阳离子采用面心立方最密堆积方式,设其晶胞参数为apm,则r(Mn2+)为______pm晶胞密度是_____g/cm3(用含a的表达式表示)
-
近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(Ni0.1Co0.9P)。回答下列问题:
(1)Co在元素周期表中的位置为_______,Co2+价层电子排布式为_______。
(2)Co、Ni可形成[Co(NH3)6]Cl2、K3[Co(NH3)6]、Ni(CO)4、[Ni(NH3)6]SO4等多种配合物。
①SO42-的空间构型为_____,NO3-中N原子的杂化轨道类型为_______。
②C、N、O、S四种元素中,第一电离能最大的是_______。
③1 mol [Co(NH3)6]Cl2中含有σ键的数目为______;已知NF3比NH3的沸点小得多,试解释原因_______。
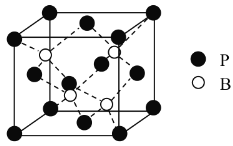
(3)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为ρ g·cm-3,计算晶体中硼原子和磷原子的最近核间距为________cm。
-
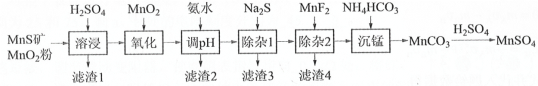
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
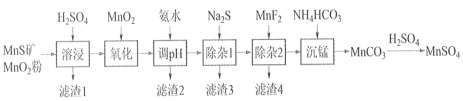
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的 pH 范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的 pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有___________ 和SiO2;
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是________________之间。
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:__________________。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是__________________(有利、不利、无影响)。
(5)在溶浸前,先把矿石研磨成粉末的原因:_______________________。
-
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀 pH范围如下:
pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8 3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)写出基态锰原子核外电子排布式___。
(2)“氧化”中添加适量的MnO2发生反应的离子方程式是___。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___~6之间。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___。
(5)写出“沉锰”的离子方程式___。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=___。
时,z=___。
-
钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
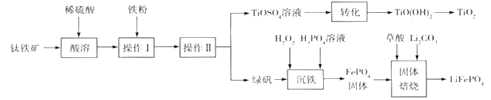
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
-
(1)用 地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是 ;目前应用最多的太阳能电池的光电转化材料是 ;
地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是 ;目前应用最多的太阳能电池的光电转化材料是 ;
(2)某气态氧化物的化学式为XO2,在标准状况下,1.92 g 该氧化物的体积为672 mL,则该氧化物的摩尔质量为 _____。
(3)某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下 实验:
实验:
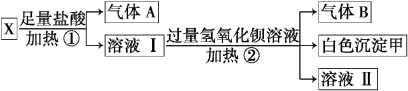
(1)白色沉淀甲是_____ ___。
___。
(2)试写出实验过程中生成气体B的离子方程式 ________________________ _。
_。
(3)通过上述实验,可确定X溶液中一定存在的离子是_______________________。













