-
下列说法正确的是( )
A. 二氯甲烷(CH2Cl2)分子的中心原子是sp3杂化,分子空间构型为正四面体结构
B. 分子晶体中一定含有共价键
C. BCl3、PCl5、H2O分子中均有一种原子的最外层电子不满足8e-稳定结构
D. 由原子间通过共价键形成的晶体一定比其他类别晶体熔、沸点高
难度: 中等查看答案及解析
-
以下能级符号不正确的是
A.3s B.3d C.3p D. 3f
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据表所列数据判断错误的是
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A.基态碳原子的价电子轨道表示式为
B.NH4Cl 的电子式:
C.HClO的结构式:H—Cl—O
D.Cr原子的基态电子排布式为[Ar]3d44s2
难度: 中等查看答案及解析
-
以下元素中,基态原子核外电子分布在7个不同能级的是
A. N B. Cl C. Ti D. Br
难度: 简单查看答案及解析
-
下列物质分子中既有σ键,又有π键的( )
①HCl ②H2O ③N2 ④C2H2 ⑤C2H4
A.①②③ B.③④⑤ C.①③ D.④⑤
难度: 简单查看答案及解析
-
下列物质中,由极性键和非极性键构成的非极性分子是( )
A. C2H2 B. NH3 C. H2O D. NaOH
难度: 简单查看答案及解析
-
氮化硼是一种新合成的结构材料,它是超硬、耐磨、耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是
A. 硝酸钠和金刚石 B. 晶体硅和水晶
C. 冰和干冰 D. 苯和酒精
难度: 中等查看答案及解析
-
下列有关共价键和键参数的说法不正确的是
A.一个乙烯(C2H4)分子中含有5个σ 键和1个π 键
B.C-H键比Si-H键键长更短,故CH4比SiH4更稳定
C.由于孤电子对的存在,H2O分子的键角小于109°28′
D.碳碳双键比碳碳单键键能更大,故碳碳双键更稳定
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p2; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。
则下列有关比较中正确的是( )
A.最高正化合价:④>③=②>① B.原子半径:②>①>④>③
C.第一电离能:①>②>③>④ D.电负性:④>③>②>①
难度: 困难查看答案及解析
-
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A>B; ②离子半径A>B ③A的正价与B的负价绝对值一定相等;④ 电负性A<B; ⑤第一电离能A>B。其中正确的组合是
A.①④ B.②③④ C.①③⑤ D.②③⑤
难度: 简单查看答案及解析
-
下列有关描述正确的是
A.第一电离能:B>Be>Li
B.电负性:F>N>O
C.前四周期的元素中,未成对电子数等于其电子层数的元素共有5种
D.
与H3O+均为10e-,它们互为等电子体
难度: 中等查看答案及解析
-
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是
元素代号
X
W
Y
Z
Q
原子半径(×10-12m)
37
64
66
70
154
主要化合价
+1
-1
-2
+5、-3
+1
A.W的最高正价为十7
B.由Q 与Y 形成的化合物中只存在离子键
C.Z与X之间形成的化合物具有还原性
D.由X、Y、Z 三种元素形成的化合物的水溶液一定呈碱性
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
A.原子半径:W>Y>Z>M>X
B.热稳定性:XM>X2Z,沸点:X2Z>YX3
C.X、Y、Z三种元素形成的化合物中不可能含离子键
D.YM3、WM4分子中每个原子最外层均满足8电子结构
难度: 中等查看答案及解析
-
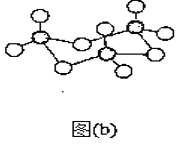
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2−+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如图所示,下列说法不正确的是( )
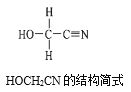
A.HOCH2CN分子中没有手性碳原子
B.1mol HOCH2CN分子中含有σ键的物质的量为5mol
C.[Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D.HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
难度: 中等查看答案及解析
-
S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。S2Cl2的结构与H2O2类似,如下图所示,下列说法正确的是
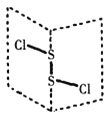
A.S2C12分子中的两个S原子均是sp杂化
B.S2Br2 与 S2C12 结构相似,熔、沸点:S2Br2<S2C12
C.S2C12是含有极性键和非极性键的极性分子
D.S2C12 与 H2O 反应的化学方程式为2S2C12 +2H2O=SO2↑+3S↓+4HC1,若反应中转移6mol电子,则生成3mol硫单质
难度: 中等查看答案及解析
-
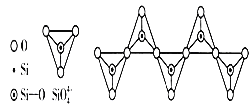
下列说法正确的是
A.键角:BF3>CH4>H2O>NH3
B.CO2、HClO、HCHO分子中一定既有σ键又有π 键
C.已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为1.5NA
D.在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图,其中Si原子的杂化方式与图中S8单质中S原子的杂化方式相同

难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是
选项
实验事实
理论解释
A
Mg原子的第一电离能大于Al原子
Mg原子3s能级全充满
B
CO2为直线形分子
CO2分子中C=O之间的夹角为109°28′
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A、B、C、D、E、F为短周期主族元素,且原子序数依次增大,前5种元素质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等。下列说法中不正确的是
A. 原子半径:r(D)>r(F)>r(A)
B. D与C也能形成化合物D2C和D2C2,两种化合物中阳离子和阴离子个数比都为2∶1
C. 把2 mol D的单质投入足量的水中,产生的气体体积为22.4 L
D. 由A、B、C三种元素组成的18电子微粒能被氧气氧化
难度: 中等查看答案及解析
-
正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构。层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
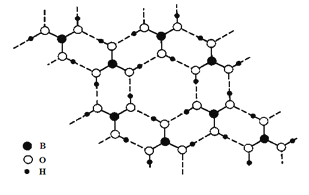
A. 正硼酸晶体属于原子晶体
B. H3BO3分子的稳定性与氢键有关
C. 分子中B原子杂化轨道的类型为sp3
D. 含1mol H3BO3的晶体中有3mol氢键
难度: 中等查看答案及解析
-
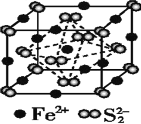
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中与每个K+距离最近的K+有6个
难度: 困难查看答案及解析
-
如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。下列判断不正确的是
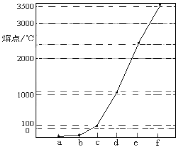
A.图中对应的e、f单质晶体熔化时克服的是共价键
B.第二电离能:c>d
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的最简单分子中含2个σ键和2个π键
难度: 中等查看答案及解析
-
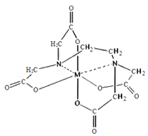
胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
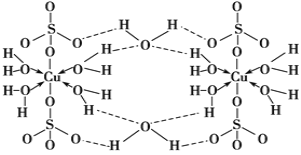
下列有关胆矾的说法正确的是( )
A. Cu2+的价电子排布式为3d84s1
B. 所有氧原子都采取sp3杂化
C. 氧原子参与形成离子键、配位键和氢键三种化学键
D. 胆矾中的水在不同温度下会分步失去
难度: 困难查看答案及解析
-
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
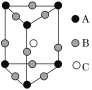
A. 1∶4∶2
B. 2∶9∶4
C. 3∶8∶4
D. 3∶9∶4
难度: 困难查看答案及解析