-
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr3+的核外电子排布式为____________________, 配离子[Cr(H2O)6] 3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)NH3是一种很好的配体,氨分子是____________(填“极性”或“非极性”)分子,NH3的沸点_____________(填“高于”、“等于”或“低于”)AsH3。
(3)科学家通过X-射线测得胆矾(CuSO4·5H2O)的结构示意图可简单表示如下:
图中虚线表示的作用力为_______________________;
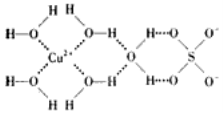
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,呈正四面体结构的原子团是_________,其中心原子的杂化类型是______。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于_________(填标号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
-
第四周期的许多金属能形成配合物.科学家通过X射线测得胆矾结构示意图可简单表示如下:

(1)Cu基态原子的外围电子排布为 ,Cr基态原子的外围电子排布为 ,这样排布的理由是 .
(2)NH3是一种很好的配体,原因是 .
(3)图中虚线表示的作用力为 .
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4•H2O晶体.在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42﹣、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是 ,写出一种与此正四面体结构互为等电子体的分子的分子式 .
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型.Ni(CO)4易溶于 (填标号).
-
第四周期的许多金属能形成配合物。科学家通过X射线测得胆矾结构示意图可简单表示如下: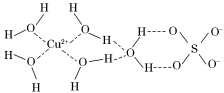
(1)Cu基态原子的外围电子排布为 ,Cr基态原子的外围电子排布为 ,这样排布的理由是_____________________。
(2)NH3是一种很好的配体,原因是______________________。
(3)图中虚线表示的作用力为________________。
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是__________,写出一种与此正四面体结构互为等电子体的分子的分子式 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
-
第四周期的许多金属能形成配合物。科学家通过X射线测得胆矾结构示意图可简单表示如下: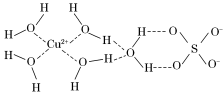
(1)Cu基态原子的外围电子排布为 ,Cr基态原子的外围电子排布为 ,这样排布的理由是_____________________。
(2)NH3是一种很好的配体,原因是______________________。
(3)图中虚线表示的作用力为________________。
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是__________,写出一种与此正四面体结构互为等电子体的分子的分子式 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
-
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“高于”“等于”或“低于”)AsH3。
(3)科学家通过X射线测得胆矾结构示意图可简单表示如下,图中虚线表示的作用力为________________。
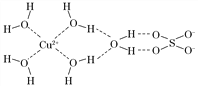
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(5)As 的卤化物的熔点如下:
| AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
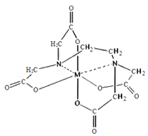
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________。
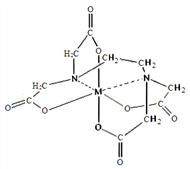
-
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________________。

(5)As的卤化物的熔点如下:
| AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________。
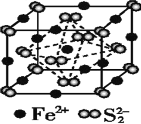
(7)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。
-
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
(1)第四周期过渡元素的明显特征是形成多种多样的配合物.
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C,O原子都符合8电子稳定结构,CO的结构式为__,与CO互为等电子体的离子为__(填化学式).
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列___________.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是__,Ga的第一电离能却明显低于Zn,原因是__.
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是__.
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
-
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥 理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
-
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥 理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
-
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式).
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列 .
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 .
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 .
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形.








