-
下列实验设计能达到实验目的的是
选项
实验目的
实验设计
A
制备NH4Cl晶体
将NH4Cl饱和溶液蒸干
B
证明溶液中含有Fe2+
向溶液中依次滴加新制氯水和KSCN溶液
C
比较Al和Al2O3熔点的高低
将铝箔在酒精灯上加热至熔化,轻轻晃动
D
验证SO2具有漂白性
将SO2通入滴有酚酞的NaOH溶液中,红色褪去
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学产品在抗击新型冠状病毒的战役中发挥了重要作用,下列说法不正确的是
A.75%的医用酒精常用于消毒,用95%的酒精消毒效果更好
B.“84”消毒液的主要成分是次氯酸钠
C.用硝酸铵制备医用速冷冰袋是利用了硝酸铵溶于水快速吸热的性质
D.医用防护口罩中熔喷布的生产原料主要是聚丙烯,聚丙烯的单体是丙烯
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.常温常压下,1.5g甲基(-CH3)中含有的电子数为NA
B.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
C.常温下,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
D.0.lmol环氧乙烷(
)中含有的共价键数为0.3NA
难度: 简单查看答案及解析
-
化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
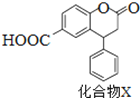
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.化合物X不能发生氧化反应
难度: 中等查看答案及解析
-
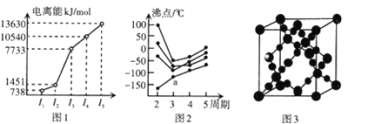
中学化学中常见的四种元素W、X、Y、Z原子序数依次增大。已知W的一种单质可供人类呼吸;X是地壳中含量最多的金属元素;含Y元素的一种盐的水溶液可用于新冠病毒的防护消毒;Y与Z形成的一种盐的溶液常用作铜制电路板的刻蚀液。下列叙述正确的是( )
A.W、Y的单质均能支持氢气燃烧
B.简单离子的半径:X>Y>W
C.含X元素的盐溶液一定呈酸性
D.W、X、Y、Z均属于短周期元素
难度: 中等查看答案及解析
-
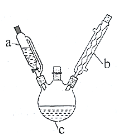
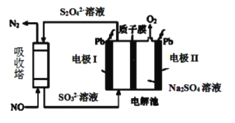
以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是

A.该电池工作时,CO32-通过隔膜移动到b极
B.若a极消耗1mol碳粉,转移电子数为4NA
C.b极的电极反应式为2CO2+O2-4e-=2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
难度: 中等查看答案及解析
-
羟氨(NH2OH)在水溶液中的电离方程式为:NH2OH+H2O
NH3OH++OH-,用0.1mol/L盐酸滴定20mL0.1mol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的OH-浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
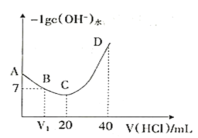
A.A到D溶液中,NH2OH电离常数不变
B.由A到D,水电离出的c(OH-)逐渐减小
C.B点对应的溶液中c(Cl-)=c(NH3OH+)
D.C点对应的溶液中c(H+)=c(OH-)+ c(NH2OH)
难度: 中等查看答案及解析
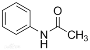 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(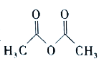 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。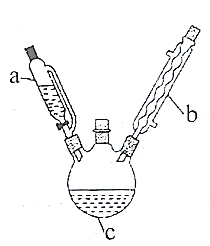
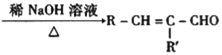 +H2O
+H2O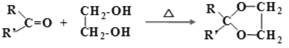 (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)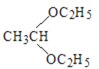 。____。
。____。