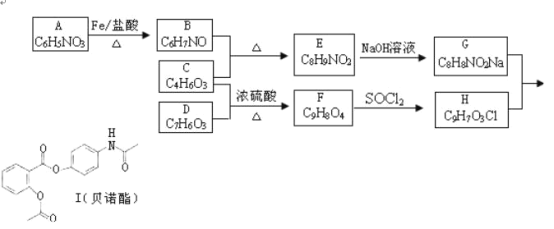
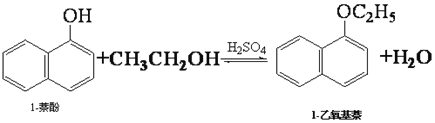-
Fe3+、SO42﹣、Al3+和X四种离子以物质的量之比2: 4 :1 :1大量共存于同一溶液中,X可能是( )
A.Na+ B.Cl﹣ C.CO32﹣ D.OH﹣
难度: 中等查看答案及解析
-
在化学的发展史上,许多科学家创建的理论对化学科学的发展起到重大的作用。有关科学家与其创建的理论对应不匹配的是( )
A.墨子:物质的分割是有条件的
B.汤姆生:葡萄干面包模型
C.德谟克利特:古典原子论
D.贝克勒尔:原子结构的行星模型
难度: 简单查看答案及解析
-
有关碳元素及其化合物的化学用语正确的是
A.CO2的电子式:
B.碳原子最外层电子的轨道表示式:
C.淀粉分子的最简式:CH2O
D.乙烯分子的比例模型

难度: 简单查看答案及解析
-
用化学方法不能实现的是( )
A.生成一种新分子 B.生成一种新离子
C.生成一种新同位素 D.生成一种新单质
难度: 简单查看答案及解析
-
下列有关判断的依据正确的是( )
A.电解质:水溶液是否导电
B.原子晶体:构成晶体的微粒是否是原子
C.共价分子:分子中原子间是否全部是共价键
D.化学平衡状态:平衡体系中各组分的物质的量浓度是否相等
难度: 简单查看答案及解析
-
学习化学应有辩证的观点和方法.下列说法正确的是( )
A.催化剂不参加化学反应
B.醇和酸反应的产物未必是酯
C.卤代烃的水解产物一定是醇
D.醇脱水的反应都属于消去反应
难度: 简单查看答案及解析
-
类推是化学学习和研究中常用的思维方法.下列类推正确的是( )
A.CO2与SiO2化学式相似,故CO2与SiO2的晶体结构也相似
B.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
C.检验溴乙烷中的溴原子可以先加氢氧化钠水溶液再加热,充分反应后加硝酸酸化,再加硝酸银,观察是否有淡黄色沉淀,则检验四氯化碳中的氯原子也可以用该方法,观察是否产生白色沉淀
D.向饱和碳酸氢钠溶液中加入氯化铵会有碳酸氢钠晶体析出,则向饱和碳酸氢钾溶液中加入氯化铵也会有碳酸氢钾晶体析出
难度: 简单查看答案及解析
-
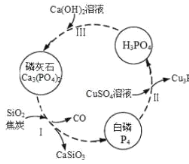
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是( )
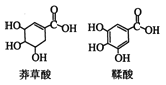
A.等浓度的两种酸其酸性相同
B.两种酸都能与溴水发生加成反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.鞣酸能与Fe3+发生显色反应,而莽草酸不能
难度: 简单查看答案及解析
-
用酸性KMnO4溶液不能达到预期目的的是
A.区别苯和甲苯
B.检验硫酸铁溶液中是否有硫酸亚铁
C.检验CH2=CHCHO中含碳碳双键
D.区别SO2和CO2
难度: 中等查看答案及解析
-
PbO2在酸性溶液中能将Mn2+氧化成MnO4﹣,本身被还原为Pb2+,取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液。下列说法错误的是( )
A.上述实验中不能用盐酸代替硫酸
B.将试管充分振荡后静置,溶液颜色变为紫色
C.在酸性条件下,PbO2的氧化性比MnO4﹣的氧化性强
D.若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol
难度: 简单查看答案及解析
-
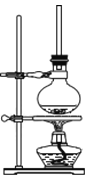
利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe−2e− =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e−=H2↑
难度: 中等查看答案及解析
-
下列关于工业生产过程的叙述正确的是( )
A.联合制碱法中循环使用CO2和NH3,以提高原料利用率
B.硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率
C.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
D.炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化成气体或炉渣除去
难度: 简单查看答案及解析
-
石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见如图。有关说法错误的是( )

A.晶体中碳原子键全部是碳碳单键
B.石墨烯与金刚石都是碳的同素异形体
C.石墨烯中所有碳原子可以处于同一个平面
D.从石墨中剥离得到石墨烯需克服分子间作用力
难度: 简单查看答案及解析
-
某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
难度: 中等查看答案及解析
-
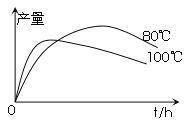
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
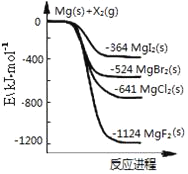
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)===MgCl2(s)+Br2(g) ΔH=-117 kJ·mol-1
难度: 中等查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
A.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O
B.NH4Cl+2H2O⇌NH3•2H2O+HCl
C.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
D.2Na2O2+2H218O=4NaOH+18O2
难度: 简单查看答案及解析
-
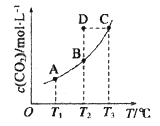
下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
NaNO3
KNO3
NaCl
KCl
10℃
80.5
21.2
35.7
31.0
100℃
175
246
39.1
56.6
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
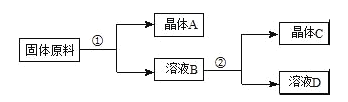
以下说法错误的是( )
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
难度: 中等查看答案及解析
-
如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是( )
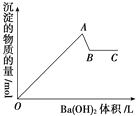
A. OA段的反应离子方程式为:2Al3++3SO
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B. AB段的离子方程式只有:Al(OH)3+OH-===AlO
+2H2O
C. A点的沉淀为Al(OH)3和BaSO4的混合物
D. B点溶液为KAlO2溶液
难度: 中等查看答案及解析