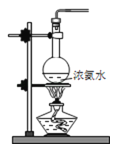
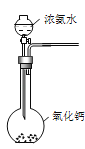
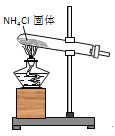
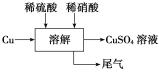
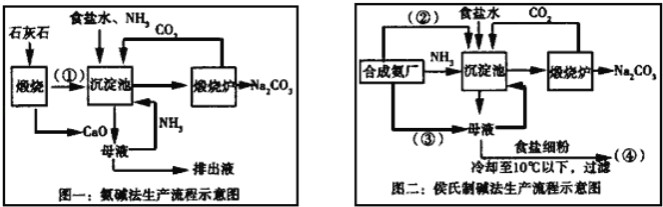
-
下列关于核外电子的描述中,正确的是( )
A.电子云图中一个小黑点表示一个电子
B.电子式中元素符号周围的小黑点数表示核外电子总数
C.s电子在s电子云的球形空间内做规则运动
D.核外电子的能量大小主要是由电子层和电子亚层决定
难度: 中等查看答案及解析
-
只能在溶液中导电的电解质是( )
A.KOH B.CH3COONH4 C.SO2 D.CH3COOH
难度: 中等查看答案及解析
-
下列液体中,滴入水中出现分层现象,滴入热的氢氧化钠溶液中分层现象不会逐渐消失的是(不考虑有机物的挥发)( )
A.溴乙烷 B.乙醛 C.橄榄油 D.汽油
难度: 中等查看答案及解析
-
ICl能发生下列变化,其中变化时会破坏化学键的是( )
A.升华 B.熔化 C.溶于CCl4 D.受热分解
难度: 简单查看答案及解析
-
强酸和强碱稀溶液的中和热可表示为 H+(aq)+OH﹣(aq)→H2O(l)+55.8kJ。已知:①HCl(aq)+NH3•H2O(aq)→NH4Cl(aq)+H2O(l)+a kJ;②HCl(aq)+NaOH(s)→NaCl(aq)+H2O(l)+b kJ;③HNO3(aq)+KOH(aq)→KNO3(aq)+H2O(l)+c kJ。则a、b、c三者的大小关系为( )
A.a>b>c
B.b>c>a
C.a=b=c
D.a=b<c
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A.NH4+ B.SO42- C.Ba2+ D.Na+
难度: 中等查看答案及解析
-
体积相同的盐酸和醋酸两种溶液,n(Cl﹣)=n(CH3COO﹣)=0.01mol,下列叙述正确的是( )
A.醋酸溶液的pH大于盐酸
B.醋酸溶液的pH小于盐酸
C.与NaOH完全中和时,醋酸消耗的NaOH多于盐酸
D.分别用水稀释相同倍数后,所得溶液中:n (Cl﹣)=n (CH3COO﹣)
难度: 中等查看答案及解析
-
人类使用材料的增多和变化标志着文明的进步,下列材料制备与化学无关的是
A.石器 B.青铜器 C.铁器 D.高分子材料
难度: 简单查看答案及解析
-
氢元素有三种同位素,各有各的丰度.其中
的丰度指的是( )
A.自然界
质量所占氢元素的百分数
B.
在海水中所占氢元素的百分数
C.自然界
个数所占氢元素的百分数
D.
在单质氢中所占氢元素的百分数
难度: 中等查看答案及解析
-
氰气[(CN)2]性质与卤素相似,分子中4个原子处于同一直线.下列叙述正确的是( )
A.是极性分子
B.键长:N≡C大于C≡C
C.CN﹣的电子式:
D.和烯烃一样能发生加成反应
难度: 中等查看答案及解析
-
常温下某H2CO3溶液的pH约为5.5,c (CO32-)约为5×10-11 mol/L,该溶液中浓度最低的离子是
A.HCO3- B.CO32- C.H+ D.OH-
难度: 中等查看答案及解析
-
储存浓硫酸的铁罐外口沾到浓硫酸会出现严重的腐蚀现象,这是因为浓硫酸具有
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.难挥发性和酸性
难度: 简单查看答案及解析
-
室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质
溶解度( g/100g水)
氯化钠
36
硝酸钾
32
硝酸钠
87
氯化钾
37
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体
难度: 中等查看答案及解析
-
将少量SO2通入Ca(ClO)2溶液中,下列离子方程式能正确表示该反应的是
A.SO2 + H2O + Ca2+ + 2ClO- → CaSO4↓ + HClO + H+ + Cl-
B.SO2 + H2O + Ca2+ + 2ClO- → CaSO3↓+ 2H+ + 2ClO-
C.SO2 + H2O + Ca2+ + ClO- → CaSO3↓+ 2HClO
D.SO2 + H2O + Ca2+ + ClO- → CaSO4↓ + 2H+ + Cl-
难度: 困难查看答案及解析
-
MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
A.Mg(HCO3)2、NaCl B.MgO、NaCl C.MgCl2、Na2CO3 D.MgCO3、NaCl
难度: 中等查看答案及解析
-
已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4
2PbSO4+2H2O下列说法中错误的是( )
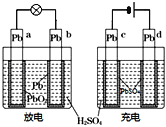
A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
难度: 中等查看答案及解析
-
将胆矾与生石灰、水按质量比为1:0.56:100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4•xCaSO4•xCu(OH)2•yCa(OH)2,当x=3时,y为( )
A.1 B.3 C.5 D.7
难度: 中等查看答案及解析