-
氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是
A.含有离子键 B.属于原子晶体
C.既有离子键又有共价键 D.属于离子晶体
难度: 简单查看答案及解析
-
已建立化学平衡的某可逆反应,当改变条件使平衡向正反应方向移动,正确的是
A.生成物的百分含量一定增加 B.正反应速率大于逆反应速率
C.反应物的转化率一定增大 D.反应物浓度一定降低
难度: 简单查看答案及解析
-
化学用语准确的是
A.铁触煤 B.氨盐
C.硬脂酸 D.活性碳
难度: 中等查看答案及解析
-
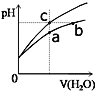
元素周期表中氧元素的数据如图,说法正确的是
A.氧元素的质量数是16
B.氧元素的相对原子质量是16.00
C.氧原子2p亚层有一个未成对电子
D.氧原子最外层有6个能量相同的电子
难度: 简单查看答案及解析
-
下列变化不涉及氧化还原反应的是
A.明矾净水 B.钢铁生锈 C.海水提溴 D.工业固氮
难度: 简单查看答案及解析
-
用化学方法不能实现的是
A.生成一种新分子 B.生成一种新离子
C.生成一种新单质 D.生成一种新原子
难度: 简单查看答案及解析
-
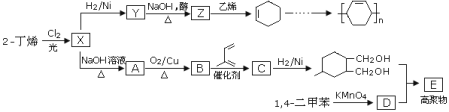
关于煤与石油化工的说法,正确的是( )
A. 煤焦油干馏可得到苯、甲苯等
B. 煤裂化可得到汽油、柴油、煤油等轻质油
C. 石油分馏可得到乙烯、丙烯等重要化工产品
D. 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物
难度: 简单查看答案及解析
-
某温度下,浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,该溶液呈中性的依据是
A.a=b
B.HA与BOH的电离常数相等
C.混合溶液中,c(H+)=
mol/L
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
难度: 中等查看答案及解析
-
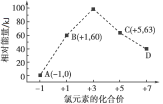
类比推断是学习化学的一种重要方法,推断正确的是
A.电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg
B.Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu
C.通常元素的价态越高对应物质的氧化性越强,故HClO4的氧化性强于HClO
D.CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2
难度: 中等查看答案及解析
-
图为周期表中短周期的一部分,若R原子核外有3个未成对电子,说法正确的是
A.原子半径大小顺序是:Y>X>R
B.其气态氢化物的稳定性顺序是:Z>Y>X>R
C.X、Y、Z中Z的氧化物对应的水化物的酸性最强
D.R的气态氢化物与它的含氧酸之间能发生化学反应
难度: 中等查看答案及解析
-
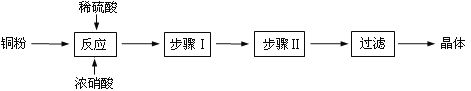
氯雷他定是缓解过敏症状的药物,其分子结构简式如图,说法正确的是

A.该分子中存在肽键
B.最多可以有12个碳原子共平面
C.1 mol氯雷他定最多可与8 mol氢气发生加成反应
D.能与NaOH溶液反应,但不能与NaHCO3溶液反应
难度: 中等查看答案及解析
-
化学反应时,反应物的量不同,产物或现象可能会发生变化。下列说法正确的是
A.硫在少量氧气中燃烧成SO2,过量能生成SO3
B.铁丝在少量氯气中燃烧生成FeCl2,过量则生成FeCl3
C.氯水滴入淀粉碘化钾稀溶液中,少量氯水有蓝色,过量蓝色消失
D.NaClO溶液中通少量CO2生成Na2CO3和HClO,过量生成NaHCO3和HClO
难度: 中等查看答案及解析
-
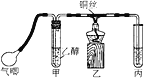
如图是模拟电化学反应装置图。下列说法正确的是
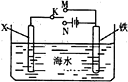
A.若X为碳棒,开关K置于N处,可以加快铁的腐蚀
B.若X为碳棒,开关K置于N处,则X极附近溶液变黄色
C.若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法
D.若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH-
难度: 中等查看答案及解析
-
利用下列实验装置能完成相应实验的是
A.装置①可干燥、收集并吸收多余的NH3
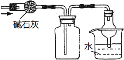
B.装置②除去CO2中含有的少量HCl
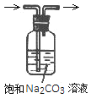
C.装置③可以制备大量的乙炔气体
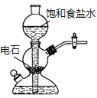
D.装置④不添加任何仪器即可检查气密性
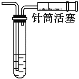
难度: 中等查看答案及解析
-
已知N2(g)+3H2(g)
2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是
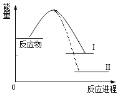
A.1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热
B.N2(g)+3H2(g)
2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
难度: 中等查看答案及解析
-
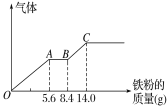
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。以下推测错误的是

A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液中n(Mg2+):n(Al3+):n(NH4+)=1∶1∶2
D.实验所加的NaOH溶液浓度为2mol/L
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.苯酚与碳酸氢钠溶液混合:C6H5OH+ HCO3-=C6H5O-+ CO2↑+ H2O
B.向FeBr2溶液中通入等量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.将Al投入NaOH的重水溶液:2Al+2OH-+2D2O=2AlO2-+3D2↑
D.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
难度: 中等查看答案及解析