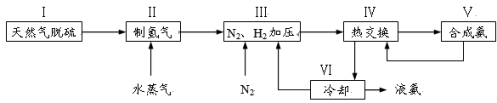-
Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________。当消耗标况下22.4升富氧空气时,有________mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g) 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________。
-
(本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g) CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

-
(14分)某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程:
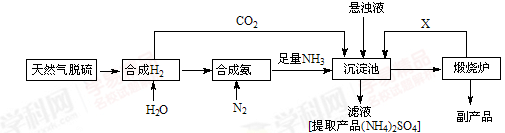
请回答以下问题:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)工业上在500℃左右使用铁触媒作为催化剂合成NH3,
①铁触媒中含有Fe3+,,则Fe3+的核外电子排布式为
②500℃时,合成塔中的反应为:N2(g)+3H2(g) 2NH3(g) ∆H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。
2NH3(g) ∆H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。

(3)沉淀池中反应的化学方程式为
(4)在上述流程中可以循环使用的X是 (填化学式),从(NH4)2SO4溶液中获得 (NH4)2SO4晶体操作的步骤是是加热浓缩、 、过滤、洗涤、干燥。
-
某些天然气开采中含有H2S气体,为了安全、有效地利用这一资源,提高经济价值,工业上可以采取多种处理方式。
Ⅰ.吸收:
(1)加工过程中常用氨水吸收H2S,产物为NH4HS,请写出对应的化学方程式: 。
Ⅱ.再利用:加工过程中产生的H2S废气可用来制H2,既廉价又环保。工业上采用以下两种方法制备H2
1高温热分解法
已知:H2S(g) H2(g)+S(g) △H
H2(g)+S(g) △H
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。请回答:
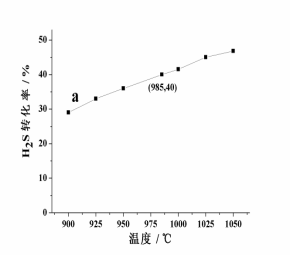
(2)△H 0(填 “>”或者“<”),你判断的依据是: 。
ii.图中a为H2S的平衡转化率与温度关系曲线,
(3)据图计算985℃时H2S按上述反应分解的平衡常数K=________
2电化学法
已知:该法制氢过程的示意图如右,FeCl3溶液可作为H2S的吸收液。
请回答:
(4)反应池中发生反应的离子方程式为_____________。
(5)请结合化学用语解释说明该装置能够产生H2的原因 。
(6)该装置除了能够制氢外,还具有何种优点?请你评价 。
-
(本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为: N2(g)+3H2(g) 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
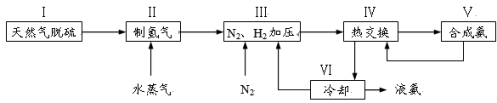
完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
-
天然气是一种重要的化工原料,其中含有少量H2S羰基硫(COS),能引起催化剂中毒、化学产品质量下降和大气污染。
(1)氨水可以吸收H2S,若生成物是NH4HS,写出反应的离子方程式___。
(2)利用含Fe3+的溶液可以脱除其中的H2S。将H2S和空气按一定流速通酸性FeCl3溶液,可实现空气脱硫得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S)随时间t变化如图。
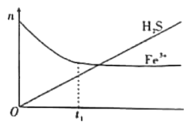
①t1以前,溶液中n(Fe3+)不断减小的原因是___(用离子方程式表示)。
②t1以后,溶液中n(Fe3+)基本保持不变,原因是___。此时,溶液中总反应的离子方程式可以表示为___。
(3)羰基硫的碱性水解是常用的脱硫方法,其流程如图:

①已知B是硫化钠,C是一种正盐,则B的电子式为___,C的化学式为___。
②写出反应②的离子方程式___。
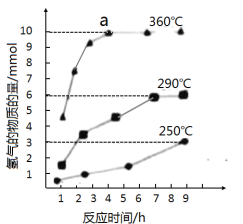
③如图是反应②中,在不同反应温度下.反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图像分析可知,a点时溶液中除S2O32-外,还有___(填含硫微粒的离子符号)。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
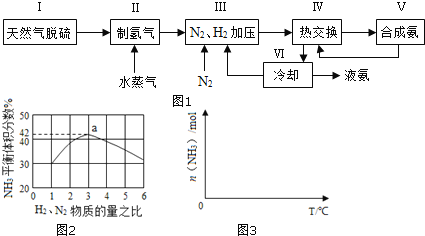
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ∆H= —92.4kJ•mol‾1 一种工业合成氨的简易流程图如下:
2NH3(g) ∆H= —92.4kJ•mol‾1 一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,写出氨水的电离方程式 。吸收产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出吸收液再生反应的化学方程式 。
(2)步骤II中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) △H=+206.4 kJ·mol-1
CO(g)+3H2(g) △H=+206.4 kJ·mol-1
②CO(g)+ H2O(g)  CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)  CO2(g)+4H2(g) △H= kJ·mol-1。
CO2(g)+4H2(g) △H= kJ·mol-1。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是(填编号) 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O蒸气反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(4)下图1表示500℃、60.0MPa条件下,H2和N2为原料气的投料比与平衡时NH3体积分数的关系。根 据图中a点数据计算N2的平衡体积分数为 。
(5)依据温度对合成氨反应的影响,在下图2坐标系中,画出一定条件下的密闭容器内,从通入起始原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
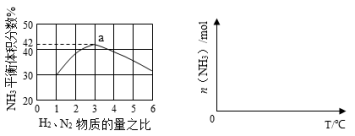
图1 图2
(6)简述本流程中提高合成氨原料总转化率的方法 。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
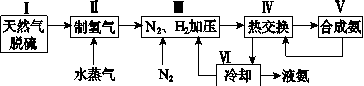
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
ⅰCH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
ⅱCO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
②利用反应ⅱ,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
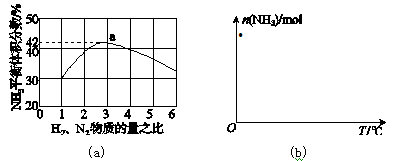
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)