-
中央电视台《国家宝藏》栏目不仅彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法不正确的是:
A.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南中“杓”的材质为Fe3O4
B.宋《莲塘乳鸭图》缂丝中使用的蚕丝的主要成分是蛋白质
C.宋王希孟《千里江山图》中的绿色颜料铜绿,主要成分是碱式碳酸铜
D.清乾隆“瓷母”是指各种釉彩大瓶,其主要成分是二氧化硅
难度: 简单查看答案及解析
-
设NA代表阿伏伽德罗常数的值,下列说法正确的是
A.28 g的乙烯和环丙烷混合气体中所含原子总数为6NA
B.在标准状况下,9.2 g NO2含有的分子数为0.2NA
C.常温下,56 g铁与足量的浓硫酸反应,转移的电子数为3NA
D.公共场所用75%的乙醇杀菌消毒预防新冠病毒, 1 mol乙醇分子中含有的共价键的数目为7NA
难度: 中等查看答案及解析
-
萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
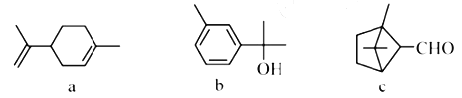
A.a和b都属于芳香烃
B.a和c分子中所有碳原子均处于同一平面上
C.在一定条件a、b和c均能与氢气发生加成反应
D.b和c均能与新制Cu(OH)2悬浊液反应生成砖红色沉淀
难度: 中等查看答案及解析
-
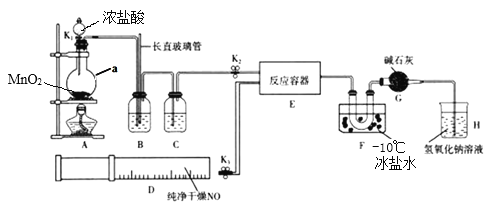
碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl 3+6NH4HCO3=La2(CO3)3↓+6NH4C1+3CO2↑+3H2O,某化学兴趣小组利用下列实验装置模拟制备碳酸镧。下列说法不正确的是
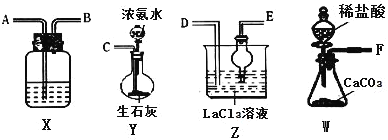
A.制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C
B.Y中发生反应的化学方程式为NH3·H2O+CaO=Ca(OH)2+NH 3↑
C.X中盛放的试剂是饱和NaHCO3溶液,其作用为吸收挥发的HCl,同时生成CO2
D.Z中应先通入CO2,后通入过量的NH3
难度: 中等查看答案及解析
-
短周期主族元素a、b、c、d的原子序数依次增大。这四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时, 0.01 mol/L w溶液pH=12。上述物质的转化关系如图所示。下列说法正确的是( )
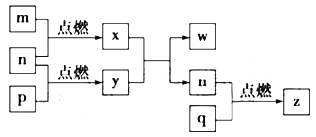
A.原子半径的大小:a<b<c<d
B.氢化物的稳定性:b<d
C.y中阴阳离子个数比为1:2
D.等物质的量y、w溶于等体积的水得到物质的量浓度相同的溶液
难度: 中等查看答案及解析
-
我国历史悠久,有灿烂的青铜文明,出土大量的青铜器。研究青铜器中(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
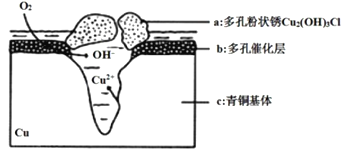
A.青铜器发生电化学腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+4e-+2H2O=4OH-
C.环境中的C1-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
D.若生成2 mol Cu2(OH)3Cl, 则理论上消耗标准状况下O2的体积为22.4 L
难度: 中等查看答案及解析
-
25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
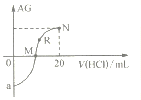
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
难度: 困难查看答案及解析
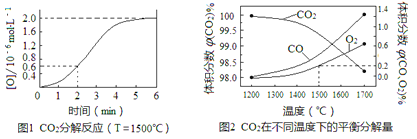
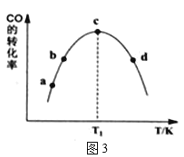
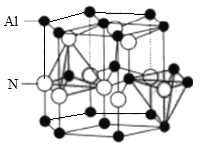
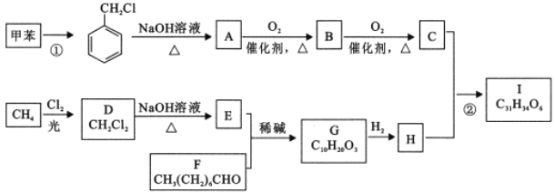
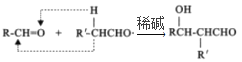
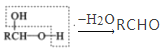 RCHO
RCHO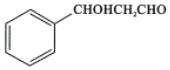 的合成路线。无机试剂任选,合成路线的表示方式为:
的合成路线。无机试剂任选,合成路线的表示方式为: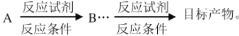 _____________.
_____________.