-
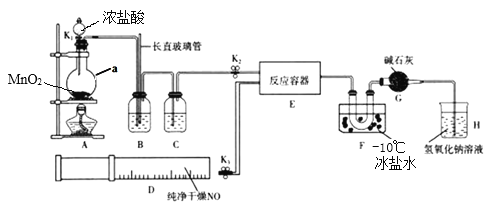
亚硝酰氯(NOCl)是有机合成中的重要试剂, 可由NO与Cl2在通常条件下反应得到。某学习小组在实验室用如图所示装置制备NOCl。
已知:亚硝酰氯(NOCl)的熔点为-64.5℃、沸点为-5.5℃, 气态呈黄色,液态时呈红褐色,易与水反应。
请回答下列问题:
(1)装置A中仪器a的名称是____________。
(2)实验开始时,应先打开K2,再打开____________(填K1”或K3”),通入一段时间气体,其目的是____________。
(3)实验时利用装置B除去某些杂质气体并通过观察B中的气泡来判断反应速率,装置B中的长直玻璃管还具有的作用是____________。
(4)装置C中应选用的试剂为____________(填试剂名称)。
(5)装置F的作用是____________。
(6)工业上可用间接电化学法除去NO,其原理如图所示,吸收塔中发生的反应为:NO+S2O42-+H 2O——N2+HSO3-(未配平)
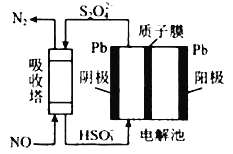
①吸收塔内发生反应的氧化剂与还原剂物质的量之比为________。
②阴极的电极反应式为_______。
(7)NOCl与H2O反应生成HNO2和HCl。请设计实验证明HNO2是弱酸:_______。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用C12和NO按如下装置(部分装置省略)制备NOCl并测定其纯度。
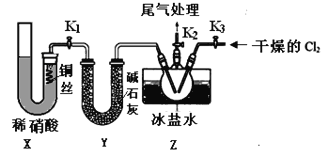
(1)实验室制备Cl2反应的离子方程式为___________________。
(2)图中X装置制备NO的优点为________________________。
(3)检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的为________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
(4)若无装置Y,则Z中NOCl可能发生反应的化学方程式为____________________。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
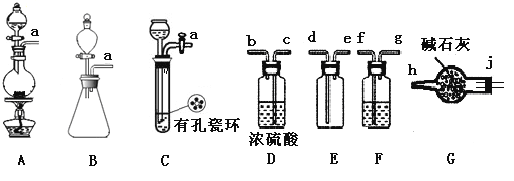
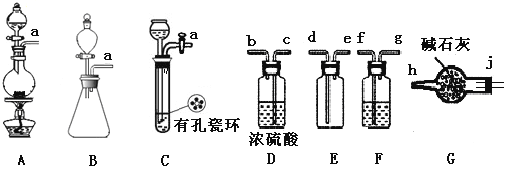
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
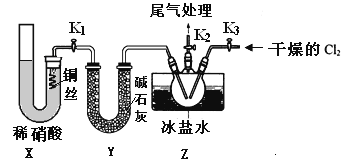
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
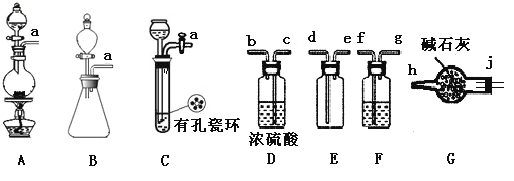
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
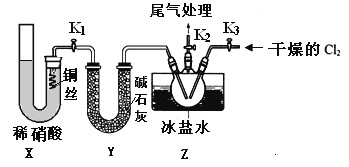
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
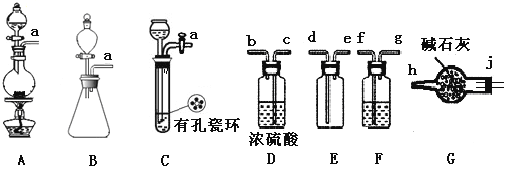
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
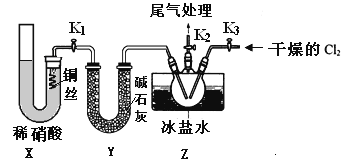
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:

(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
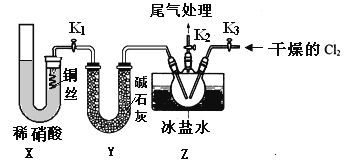
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:

(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
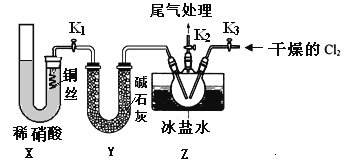
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
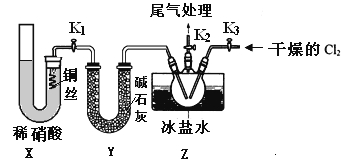
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
(本题共10分)
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯)。亚硝酰氯的熔点为-64.5 ℃,沸点为-5.5 ℃,并且遇水蒸气分解为氮的氧化物和氯化氢。
某校化学兴趣小组按如下流程制备亚硝酰氯,实验时,先通入Cl2,待E中U形管内充满黄绿色气体时,再缓缓通入NO。“→”表示气流方向。
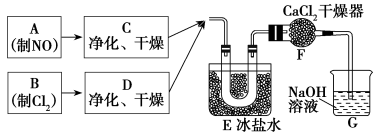
34.实验室用氯酸钾和浓盐酸制备Cl2的化学方程式是______________________________。
35.装置F的作用是___________________________________。
36.亚硝酰氯与水反应的化学方程式是________________________________。
37.实验中“先通入Cl2,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是______________________________________________________________。
-
亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成,某化学兴趣小组设计如图装置制备NOC1。回答下列相关问题:
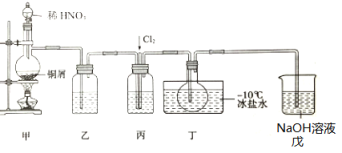
(1)NOCl分子中各原子均满足8电子稳定结构,NOCl的电子式为___。
(2)装置乙中的液体为___,装置丙作用是___。
(3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这样操作目的是___。待丁中烧瓶内有一定量液体生成时,停止实验。
(4)上述装置设计有一不妥之处,理由是___(用化学方程式表示)。
(5)测定NOCl的纯度:取所得产物a g溶于水,配制成250mL溶液;取25.00mL于锥形瓶中,以K2Cr2O7溶液为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为24.00mL。滴定终点的现象是___,亚硝酰氯(NOCl)的纯度为___。(Ag2CrO4砖红色:Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4)。
















