-
《本草纲目》记载:“凡使白矾石,以瓷瓶盛。于火中,令内外通赤,用钳揭起盖,旋安石峰巢人內烧之。每十两用巢六两,烧尽为度。取出放冷,研粉”。在实验室完成该操作,没有用到的仪器是
A.蒸发皿 B.坩埚 C.坩埚钳 D.研钵
难度: 中等查看答案及解析
-
下列说法错误的是
A.过氧碳酸钠(2Na2CO3·3H2O2)具有碳酸钠和H2O2的双重性质,可作去污剂、消毒剂
B.亚硝酸钠具有防腐的作用,所以可在食品中适量添加以延长保质期。
C.不锈钢是通过改变材料的内部结构达到防锈蚀的目的
D.“碳纳米泡沫”与石墨烯互为同分异构体
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
难度: 中等查看答案及解析
-
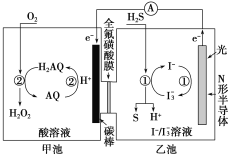
以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:
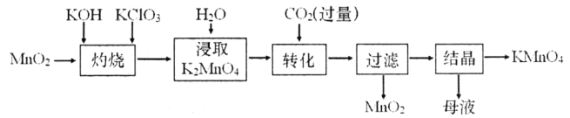
下列说法正确的是
A.“灼烧”可在石英坩埚中进行
B.母液中的溶质是K2CO3、KHCO3、KCl
C.“结晶”环节采用加热蒸发结晶的方法
D.“转化”反应中,生成的KMnO4和MnO2的物质的量之比为2︰1
难度: 中等查看答案及解析
-
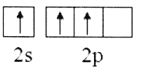
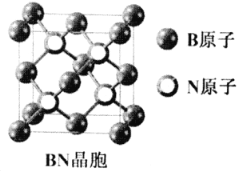
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 原子半径大小:W>Z>Y>X
难度: 中等查看答案及解析
-
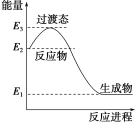
我国成功研制的新型可充电 AGDIB电池(铝—石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1Al。放电过程如图,下列说法正确的是( )
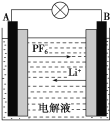
A.B为负极,放电时铝失电子
B.充电时,与外加电源负极相连一端电极反应为LiyAl-e-=Li++Liy-1Al
C.充电时A电极反应式为Cx+PF
-e-=CxPF6
D.废旧 AGDIB电池进行“放电处理”时,若转移1 mol电子,石墨电极上可回收7 g Li
难度: 中等查看答案及解析
-
常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中-lg
和-lg c(HC2O4-)或-lg
和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )
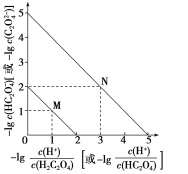
A.Ka1(H2C2O4)数量级为10-1
B.曲线N表示-lg
和-lg c(HC2O4-)的关系
C.向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O4-)相等,此时溶液pH约为5
D.在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
难度: 困难查看答案及解析

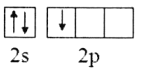 B.
B.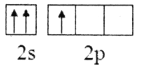
 D.
D.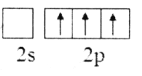

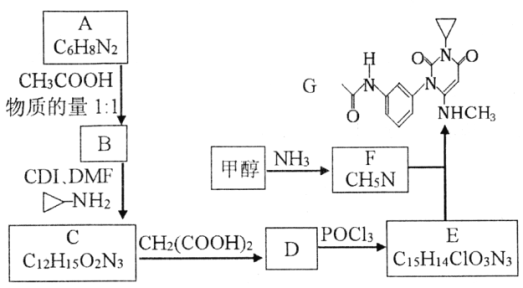
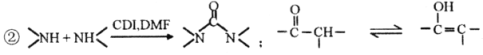
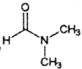 ,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________