-
国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
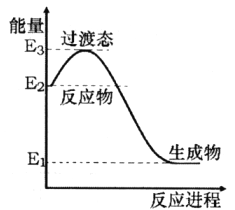
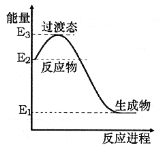
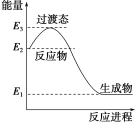
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式___________。
(2)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g) N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
①一定条件下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应I的活化能EI___________反应Ⅱ的活化能EII(填“>”、“<”、或“=”)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数___________k2逆增大的倍数(填“大于”、“小于”、或“等于”)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
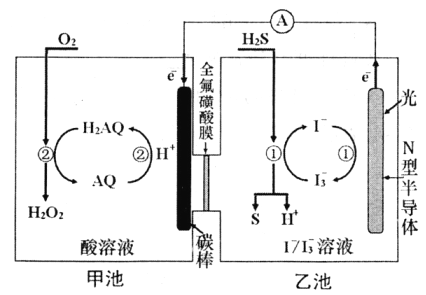
①装置中H+向___________池迁移。
②乙池溶液中发生反应的离子方程式:______________________。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
-
国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式___________。

(2)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g) N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
①一定条件下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应I的活化能EI___________反应Ⅱ的活化能EII(填“>”、“<”、或“=”)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数___________k2逆增大的倍数(填“大于”、“小于”、或“等于”)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向___________池迁移。
②乙池溶液中发生反应的离子方程式:______________________。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
-
国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式________________________________。
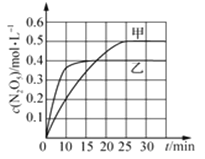
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g) N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |
①0-10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数K的值为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2 D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
(3)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
-
国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。如图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________。
(2)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应Ⅰ:2NO(g) N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
①一定条件下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数__________(填“大于”“小于”或“等于”)k2逆增大的倍数。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
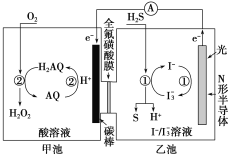
①装置中H+向_______池迁移。
②乙池溶液中发生反应的离子方程式:_______。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25 ℃,某废液中c(Mn2+)=0.02 mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1 mol·L-1,此时pH约为_______(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:Ka1=1.5×10-7,Ka2=6.0×10-15,lg 6=0.8)。
-
化学与人类生产、生活、科研密切相关,下列有关说法不正确的是
A. 维生素C常用作抗氧化剂,说明它具有还原性
B. 大力实施矿物燃料的脱硫脱硝技术,可以减少SO2、NO2的排放
C. 工业生产玻璃、水泥.均需用石灰石作原料
D. 糖类、蛋白质和油脂都属于营养物质,都能发生水解反应
-
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为______L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ•mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=______.
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.
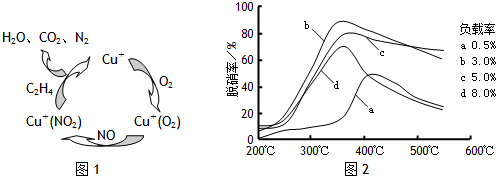
①写出该脱硝原理总反应的化学方程式:______ 3N2+4CO2+4H2O
-
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)选择性催化还原法的脱硝原理为:
6NOx+4x NH3  (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为________L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=__________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

①出该脱硝原理总反应的化学方程式:____________。
②为达到最佳脱硝效果,应采取的条件是____________。
-
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为______L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ•mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=______.
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.
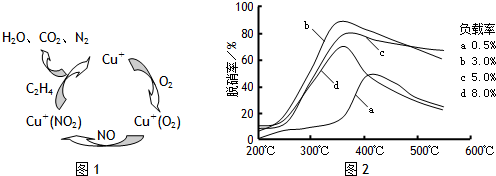
①写出该脱硝原理总反应的化学方程式:______ 3N2+4CO2+4H2O
-
人类向大气中排放的NOx和SO2对环境会产生危害,烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点。
(1)选择性催化还原技术是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3选择性地与NOx反应生成N2和H2O。
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1=-905.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) ΔH3=__。
(2)碱性KMnO4氧化法也可将NOx进行脱除。
①用KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整。__
□NO+□MnO4-+□__=NO2-+3NO3-+□MnO42-+□__
②下列叙述正确的是__(填字母序号)。
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:c(MnO4-)+2c(MnO42-)=c(K+)
C.在不同酸碱性条件下,KMnO4发生还原反应的产物可能不同
(3)催化剂V2O5可用于处理NOx和SO2。
V2O5在催化降解NOx的过程中,也会对SO2和O2反应起到一定的催化作用,其反应式如下:
a.V2O5+SO2=V2O4+SO3
b.__
c.2VOSO4=V2O5+SO2+SO3
SO3进一步与烟气中逃逸的氨反应,生成硫酸氢铵和硫酸铵。
-
化学与环境保护、工业生产、生活等密切相关。下列说法不正确的是
A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅
B.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
C.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
D.硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药和炸药

2NO2(g)的反应历程如下:
N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。









