-
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
难度: 简单查看答案及解析
-
下列微粒表示正确且能促进H2O的电离的是
A.2H+
B.
C.
D.
难度: 简单查看答案及解析
-
常温下,下列溶液中一定能大量共存的离子组是
A.使甲基橙变红色的溶液:Na+、AlO2—、SO42—、Cl—
B.澄清透明溶液:K+、H+、MnO4—、SO42—
C.能与铝反应产生氢气的溶液:Na+、CO32—、Fe3+、Cl—
D.c(H+)/c(OH—)=1012的溶液中:Fe2+、Cu2+、SO42—、NO3—
难度: 简单查看答案及解析
-
下列有关实验装置的说法中正确的是

A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Ba(OH)2溶液与过量的NaHCO3溶液混合:Ba2++2OH—+2HCO3-=BaCO3↓+CO32—+2H2O
B.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入适量盐酸:
3Fe2++4H++NO3—=3Fe3++NO↑+2H2O
C.少量的氯气通入溴化亚铁溶液:3Cl2+2Fe2++4Br—=6Cl—+2Fe3++2Br2
D.氧化铁粉末投入氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温下,3.9g Na2O2与足量的水反应,转移的电子数为0.1 NA
B.100 mL 1 mol·L-1 Na2CO3溶液中含有的阴离子数大于0.1NA
C.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
D.标准状况下,0.56 L的四氯化碳中含有的C—Cl数为0.1NA
难度: 简单查看答案及解析
-
下列说法不正确的是
A.除去N2中的少量O2:通过灼热的Cu粉,收集气体
B.铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4
C.用盐酸酸化KMnO4溶液可以增强其氧化性
D.强电解质在水中溶解度不一定大于弱电解质在水中的溶解度
难度: 简单查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
A.原子半径:X>Y>Q>W
B.Q和W可形成原子个数比为1∶1和2∶1的化合物
C.Q和Z所形成的分子空间构型为直线形
D.X、Y和W三种元素形成的化合物的水溶液呈碱性
难度: 简单查看答案及解析
-
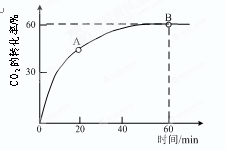
锰酸锂离子蓄电池是第二代锂离子动力电池。它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位。电池反应式为:Li1-xMnO4+LixC
LiMnO4+C。
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池上标注有“+”的电极应于外接电源的负极相连
难度: 简单查看答案及解析
-
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L—1盐酸、③0.1 mol·L—1氯化镁溶液、④0.1 mol·L—1硝酸银溶液中,Ag+浓度:①>④=②>③
D.用0.2000 mol·L—1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L—1),至中性时,溶液中的酸未被完全中和
难度: 简单查看答案及解析
-
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
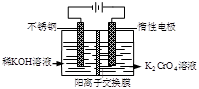
下列说法不正确的是
A.在阴极室,发生的电极反应为:2H2O+2e—=2OH—+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡
2CrO42—+2H+
Cr2O72—+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1-
难度: 简单查看答案及解析
-
下列叙述的实验能达到预期目的的是:
实验内容
实验目的
A
在稀AgNO3溶液中加入少量NaCl溶液产生白色沉淀后再加入适量NaI溶液,出现黄色沉淀
说明Ksp(AgCl)>Ksp(AgI)
B
分别向2支试管中加入等体积等浓度的Na2S2O3溶液,再向其中分别加入等体积不同浓度的H2SO4溶液
研究反应物浓度对化学反应速率的影响
C
向混有亚硫酸钠的硫酸钠溶液中加入适量的BaCl2溶液
检验SO42-存在
D
向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液
制备Fe(OH)3胶体
难度: 简单查看答案及解析
-
取一张用饱和NaCl溶液浸泡的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是
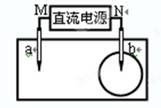
A.M是直流电的正极
B.电子流向是N→b→a→M
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
难度: 简单查看答案及解析
-
100 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48 L气体(标准状况),假定电解后溶液体积仍为100 mL,下列说法不正确的是
A.原混合溶液中c(K+)=1 mol/L
B.上述电解过程中一共转移电子0.8 mol
C.电解得到的铜的物质的量为0.2 mol
D.电解后溶液中c(H+)=2 mol/L
难度: 简单查看答案及解析
-
下列叙述正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
B.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
C.25℃时,pH=4,浓度均为0.1mol·L—1的CH3COOH、CH3COONa混合溶液:
c(CH3COO—)+c(OH—)>c(CH3COOH)+c(H+)
D.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: c(Na+)=c(SO42-) >c(NH4+) >c(OH-) =c(H+)
难度: 简单查看答案及解析