-
化学与人类生活、社会可持续发展密切相关,下列说法中不正确的是
A.2020年北京冬奥会速滑服主要材料是聚氨酯,属于有机高分子化合物
B.用CO2生产可降解塑料
,原子利用率100%,符合绿色化学原则
C.生活中菜叶、鱼骨等垃圾可以作为沼气原料,沼气属于不可再生能源
D.我国成功研制世界最大口径单体碳化硅反射镜,碳化硅属于无机非金属材料
难度: 简单查看答案及解析
-
下列有关化学研究中借助仪器分析的说法正确是
A.借助电子显微镜就可以实现对原子或分子的操纵
B.借用色谱仪(色谱分析法仪器)测定反应速率
C.借助核磁共振、红外光谱、质谱仪可以分析有机合成产物
D.借助原子吸收光谱确定物质中含有的各种金属与非金属元素
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.硝基苯结构简式:
B.镁原子的结构示意图:
C.环氧丙烷的键线式:
D.原子核内有8个中子的碳原子:
C
难度: 简单查看答案及解析
-
下列说法正确的是:
A.钠钾合金和镁铝合金都是密度小、硬度大的合金
B.玉米制乙醇、蛋白质变性和纳米银粒子的聚集都是化学变化
C.石油化工的裂解气可以作为溴水提取溴单质的萃取剂
D.中国古代采用加热胆矾或者绿矾的方法制取硫酸
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A.金属钠投到MgCl2溶液中:2Na+Mg2+=2Na++Mg
B.向NaAlO2溶液中滴加NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
C.室温下用稀HNO3溶解铜:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4(分子结构:
)中的共价键数目为6NA
B.11g超重水(T2O)含有的电子数比中子数多NA
C.标准状况下,22.4 L CHCl3中的C-Cl键的数目等于0.3NA
D.标准状况下,11.2 L Cl2溶于水呈黄绿色,溶液中Cl-、ClO-和HClO的微粒数之和为NA
难度: 中等查看答案及解析
-
三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O==2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.若1mol NF3被氧化,反应转移电子数为2NA
C.若生成0.4molHNO3,则转移0.4mol电子
D.氧化剂与还原剂的物质的量之比为1∶2
难度: 中等查看答案及解析
-
下列说法正确的是
A.2,2-二甲基丁烷的1H-NMR上有4个峰
B.
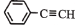 中所有原子处于同一平面上
中所有原子处于同一平面上C.一定条件下1 mol
 与KOH溶液反应,最多消耗3 mol的KOH
与KOH溶液反应,最多消耗3 mol的KOHD.甲苯能使酸性KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变活泼,被KMnO4氧化而断裂
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图所示,X、Y的核外电子数之和等于W的核外电子数,下列说法不正确的是( )
A.X、Y、Z三种元素的最高正价依次增大
B.Y、Z形成的简单氢化物,后者稳定性强
C.Y、Z形成的简单阴离子,后者半径小
D.工业上用电解W和Z形成的化合物制备单质W
难度: 困难查看答案及解析
-
某温度时,在水中的电离常数:K(CH3COOH)=K(NH3·H2O)=1.8×10-5;在冰醋酸中K(HClO4)=1.6×10-5;K1(H2SO4)=6.3×10-9,则下列说法不正确的是
A.HClO4在水中为强酸,在冰醋酸中为弱酸
B.在冰醋酸中可能发生反应:HClO4+NaHSO4=NaClO4+H2SO4
C.在某温度下,0.1 mol·L-1氨水和醋酸溶液中,c(NH4+)=c(CH3COO-)
D.氨水和HClO4溶液反应后,若c(NH4+)>c(ClO4-),则溶液呈酸性
难度: 中等查看答案及解析
-
下列实验操作或试剂的选择都合理的是
A.减压过滤时,常用倾析法先转移上部清液,溶液量不超过漏斗容量的2/3,慢慢开大水龙头,待溶液快流尽时再转移下部沉淀
B.用酸性高锰酸钾溶液检验FeCl2和FeCl3混合液中的Fe2+
C.用NaOH溶液除去溶在乙酸乙酯中的乙酸
D.向CoCl2溶液中逐滴加入浓盐酸并振荡,溶液的颜色会从蓝色逐渐变成粉红色
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.能使酚酞变红的溶液中:Na+、K+、SiO32-、CO32-
B.中性溶液中:Cl-、Mg2+、Al3+、K+
C.c(H+)/c(OH-)=1×1012 mol·L-1的溶液中:NH4+、Cu2+、SO42-、CH3COO-
D.由水电离产生的c(H+)=1×10-13 mol·L-1的溶液中:Na+、Fe2+、SCN-、NO3-
难度: 中等查看答案及解析
-
侯氏制碱法原理是:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl析出碳酸氢钠,下列实验装置及原理设计说法不合理的是:
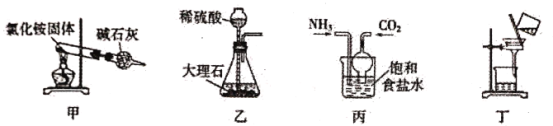
A.用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH3、HCl的遇冷会重新化合
B.用装置乙生成的CO2速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
C.用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2,也可以先通氨气再通CO2
D.用装置丁分离得到产品NaHCO3,为得到干燥产品,也可采用减压过滤
难度: 中等查看答案及解析
-
下列说法正确的是
A.食盐与石英熔化时,克服微粒间的作用力相同
B.SiHFBr2分子中所有原子的最外层均为8个稳定结构
C.重水在3.8℃时就变成了“热冰”,可能与重水分子间存在氢键有关
D.NaHSO4加热融化时破坏了该物质中的离子键和共价键
难度: 中等查看答案及解析
-
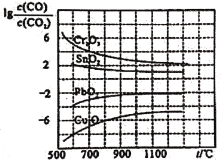
工业上把Cl2通入冷NaOH溶液中制得漂白液(有效成分为NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液中,模拟实验得到ClO-、ClO3-等离子的物质的量n(mol)与反应时间t(min)的关系曲线。下列说法错误的是
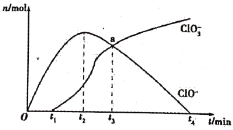
A.参加反应所需NaOH与氯气的物质的量之比一定为2:1
B.a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1
C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中通入二氧化硫
难度: 中等查看答案及解析
-
某废液阳离子只可能含有:Na+、NH4+、Ba2+、Cu2+、Fe2+、Fe3+、Al3+中的某几种,实验设计了下述方案进行处理,以回收金属,保护环境
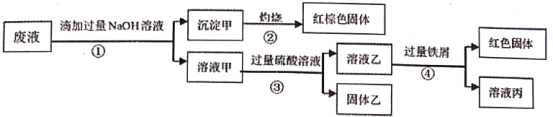
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解,下列说法正确的是:
A.根据步骤①中的现象,说明废液中一定含有Al3+
B.步骤②,由红棕色固体可知,废液中一定存在Fe3+
C.取溶液丙进行焰色反应,焰色为黄色,说明原溶液中一定含Na+
D.该废液一定含有NH4+、Ba2+、Cu2+
难度: 困难查看答案及解析


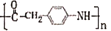
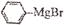 )与二苯酮反应制备三苯甲醇。
)与二苯酮反应制备三苯甲醇。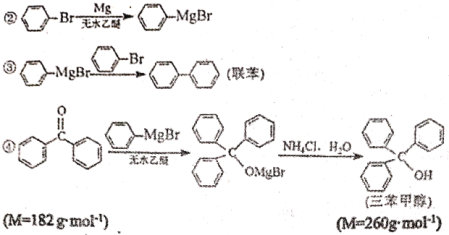

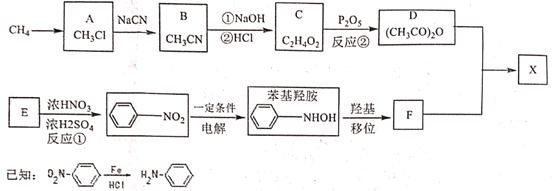
 的路线(用流程图表示,无机物任选)__________
的路线(用流程图表示,无机物任选)__________