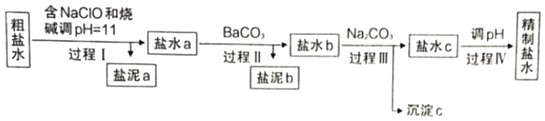
-
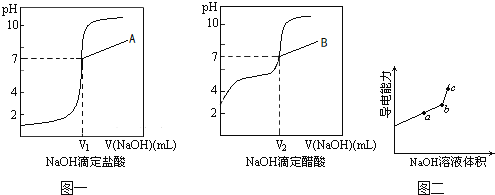
下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A
B
C
D
NaCl溶于水
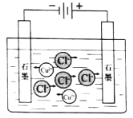
电解CuCl2溶液
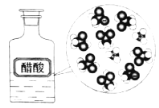
CH3COOH在水中电离
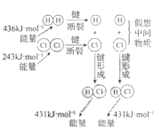 H2与Cl2反应能量变化
H2与Cl2反应能量变化NaCl
Na++Cl−
CuCl2
Cu2++2Cl−
CH3COOH
CH3COO−+H+
H2(g)+Cl2(g)
2HCl(g)
ΔH=−183kJ·mol−1
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是
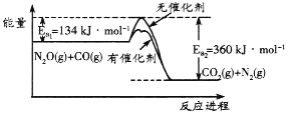
A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)===CO2(g)+N2(g) △H= - 226 kJ·mol-1
C. 反应物的总键能大于生成物的总键能
D. 该反应正反应的活化能大于逆反应的活化能
难度: 简单查看答案及解析
-
将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
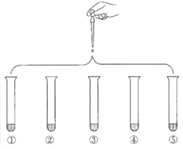
实验①:滴加4滴水,振荡
实验②:滴加4滴饱和FeCl3溶液,振荡
实验③:滴加4滴1 mol/L KCl溶液,振荡
实验④:滴加4滴1 mol/L KSCN溶液,振荡
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2O2中加入MnO2,产生O2的速度加快
C.合成氨为提高NH3的产率,理论上应采取高压低温的条件
D.氨水应密闭保存、放置于低温处
难度: 简单查看答案及解析
-
用CO合成甲醇的化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
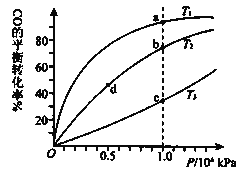
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
难度: 简单查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)⇌PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016mol•L﹣1•s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
难度: 简单查看答案及解析
-
强酸制弱酸非常重要的一种离子反应,已知:
Ka1
Ka2
H2SO3
H2CO3
下列离子反应不正确的有( )个
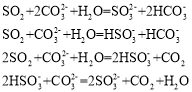
A.0个 B.1个 C.2个 D.3个
难度: 中等查看答案及解析
-
某温度下,
和
的电离常数分别为
和
。将
和体积均相同的两种酸溶液分别稀释,其
随加水体积的变化如图所示。下列叙述正确的是( )
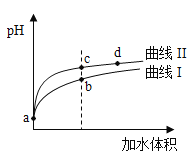
A. 曲线Ⅰ代表
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中
保持不变(其中
、
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与
恰好中和后,溶液中
相同
难度: 中等查看答案及解析
-
常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是
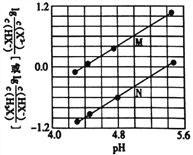
A.Kal(H2X)的数量级为10-7
B.曲线N表示lg
与pH的变化关系
C.NaHX溶液中:c(H+)<c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
难度: 困难查看答案及解析
-
某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
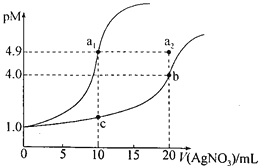
A.该温度下,Ksp(Ag2CrO4)=4×10-12
B.al、b、c三点所示溶液中c(Ag+):al>b>c
C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
难度: 困难查看答案及解析
-
下列表述正确的有( )个
①明矾和FeCl3可作净水剂 ②为保存AlCl3溶液,要在溶液中加少量盐酸 ③CuSO4溶液蒸干,灼烧,最后得到的主要固体产物是CuO ④NH4Cl与ZnCl2溶液可作焊接中的除锈剂 ⑤实验室盛放Na2SiO3溶液的试剂瓶应用磨口玻璃塞 ⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ⑦草木灰与铵态氮肥不能混合施用 ⑧除去某污水中Hg2+可以加入适量的FeS(已知:Ksp(FeS) > Ksp(HgS))
A.4 B.5 C.6 D.7
难度: 简单查看答案及解析
-
下列叙述正确的是( )
①0.1mol•L﹣1氨水中,c(OH﹣)=c(NH4+)
②10mL 0.02 mol•L﹣1 HCl溶液与10mL 0.02 mol•L﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
③在0.1 mol•L﹣1CH3COONa溶液中,c(OH﹣)=c(CH3COOH)+c(H+)
④0.1 mol•L﹣1某二元弱酸的强碱盐NaHA溶液中,c(Na+)=2c(A2﹣)+c(HA﹣)+c(H2A)
A.①②③ B.②③ C.②③④ D.①④
难度: 简单查看答案及解析
-
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法正确的是( )
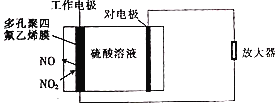
A.“对电极”是正极
B.“工作电极”上发生的电极反应为NO2+2H+-2e﹣═NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
难度: 简单查看答案及解析
-
一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是
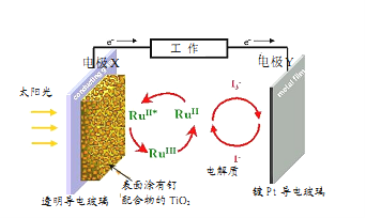
A.镀铂导电玻璃的作用是传递I-
B.电池工作时,光能转变为电能,X为电池的正极
C.电池的电解质溶液中I-和I3-的浓度均不断减小
D.电解质溶液中发生反应2Ru3++3I-═2Ru2++I3-
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.惰性电解饱和食盐水时,阳极的电极反应为2Cl﹣﹣2e﹣═Cl2↑
B.氢氧燃料电池的正极电极反应为O2+2H2O +4e﹣═4OH﹣
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为Cu﹣2e﹣═Cu2+
D.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe﹣3e﹣═Fe3+
难度: 简单查看答案及解析
-
锂—空气电池充放电基本原理如图所示,电池装置中间用高分子隔膜隔开,下列说法不正确的是( )
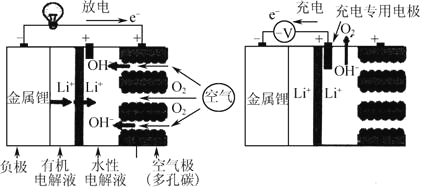
A.充电时,锂离子向阴极移动
B.充电时阴极电极反应式为Li++e- = Li
C.放电时正极电极反应式为O2+4e-+2H2O = 4OH-
D.电池装置中高分子隔膜允许水分子自由移动
难度: 简单查看答案及解析
-
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
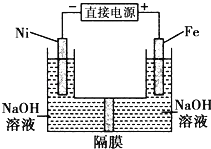
A.Fe电极是阳极,电极反应为Fe﹣6e﹣+4H2O═FeO42﹣+8H+
B.电解时电子流向:负极→Ni→电解液→Fe电极→正极
C.若隔膜为阴离子交换膜,则电解结束偶左侧溶液中含有FeO42﹣
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜,溶液混合后,与原溶液相比,阴极区pH减小
难度: 简单查看答案及解析
-
储氢作为氢能利用的关键技术,是当前关注的热点之一。一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法错误的是( )
已知:电流效率(η=
 ×100%)
×100%)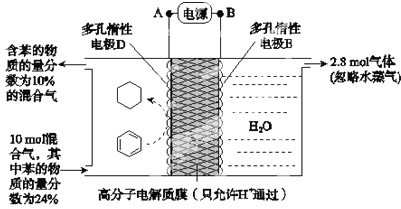
A.电源B为正极
B.导线中电子移动方向为A→D
C.电极D反应式为C6H6+6H++6e-=C6H12
D.该储氢装置的电流效率η=24.3%
难度: 简单查看答案及解析
-
一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是
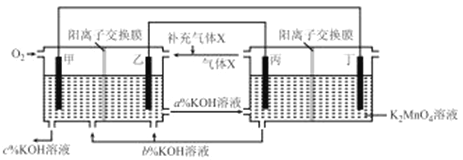
A.电极丁的反应式为MnO42- -e-= MnO4-
B.电极乙附近溶液的pH减小
C.KOH溶液的质量分数:c%>a%>b%
D.导线中流过2 mol电子时,理论上有2molK+移入阴极区
难度: 困难查看答案及解析
-
根据下图所示,下列说法正确的是
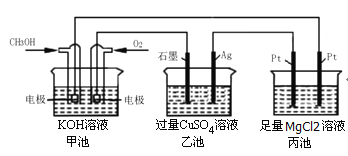
A.甲池是电能转化为化学能的装置,乙、丙是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
难度: 中等查看答案及解析