-
关于“植物油”的叙述错误的是( )
A.属于酯类 B.不含碳碳双键
C.比水轻 D.在碱和加热条件下能完全水解
难度: 简单查看答案及解析
-
I2Cl6晶体在常温下就会“升华”,蒸气冷却可得到晶体ICl3。ICl3遇水会产生大量的腐蚀性白色烟雾,有强烈的催泪性。若生成物之一是HCl,则另一种是( )
A.HIO3 B.HIO2 C.HIO D.ICl
难度: 简单查看答案及解析
-
以下物质中存在12C、13C、14C原子的是( )
①金刚石 ②CO2③石灰石 ④葡萄糖。
A.①②③④ B.①②③ C.②③④ D.②③
难度: 简单查看答案及解析
-
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A.NH4+ B.SO42- C.Ba2+ D.Na+
难度: 中等查看答案及解析
-
用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。R分子的路易斯结构式可以表示为
则以下叙述错误的是( )
A.R为三角锥形 B.R可以是BF3
C.R是极性分子 D.键角小于109°28′
难度: 简单查看答案及解析
-
炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
A.铁 B.硫 C.氧 D.碳
难度: 中等查看答案及解析
-
人的血液中存在H2CO3~HCO3﹣这样“一对”物质,前者的电离和后者的水解两个平衡使正常人血液的pH保持在7.35~7.45之间.血液中注射碱性物质时,上述电离和水解受到的影响分别是
A.促进、促进 B.促进、抑制 C.抑制、促进 D.抑制、抑制
难度: 简单查看答案及解析
-
以下情况都有气体产生,其中不产生红棕色气体的是( )
A.加热浓硝酸 B.光照硝酸银
C.加热硝酸钙 D.加热溴化钾和浓硫酸混合物
难度: 中等查看答案及解析
-
如图所示装置中不存在的仪器是( )
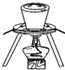
A.坩埚 B.泥三角 C.三脚架 D.石棉网
难度: 简单查看答案及解析
-
以下关于原子的未成对电子数的叙述正确的是( )
①钠、铝、氯:1个;②硅、硫:2个;③磷:3个;④铁:4个.
A.只有①③ B.只有①②③ C.只有②③④ D.有①②③④
难度: 简单查看答案及解析
-
以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
A.对钢材“发蓝”(钝化) B.选用铬铁合金
C.外接电源负极 D.连接锌块
难度: 中等查看答案及解析
-
下列有机物都可以在碱的醇溶液和加热条件下发生消去反应,条件相同时,转化率最高的是( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
根据溶解度曲线,在80 ℃时将含有等物质的量的硝酸钠和氯化钾混合溶液恒温蒸发,首先析出的是
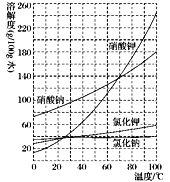
A.氯化钾 B.硝酸钠
C.氯化钠 D.硝酸钾
难度: 中等查看答案及解析
-
以下性质的比较可能错误的是( )
A.离子半径 H﹣>Li+ B.熔点 Al2O3>MgO
C.结合质子(H+)的能力 CO32﹣>ClO﹣ D.密度 1﹣氯戊烷>1﹣氯己烷
难度: 中等查看答案及解析
-
乙烷、乙炔分子中碳原子间的共用电子对数目分别是1、3,则C20H32分子中碳原子间的共用电子对数目可能为( )
A.20 B.24 C.25 D.77
难度: 中等查看答案及解析
-
在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有5 mol H2O参加反应,被水还原的溴元素为( )
A.1 mol B.2/3 mol
C.4/3 mol D.2 mol
难度: 中等查看答案及解析
-
青霉素是一元有机酸,它的钠盐的1国际单位的质量为6.00×10﹣7克,它的钾盐1国际单位的质量为6.27×10﹣7克,(1国际单位的2种盐的物质的量相等),则青霉素的相对分子质量为( )
A.371.6 B.355.6 C.333.6 D.332.6
难度: 中等查看答案及解析
-
以下物质的提纯方法错误的是(括号内为杂质)( )
A.CO2(H2S):通过CuSO4溶液
B.CH3COOH(H2O):加新制生石灰,蒸馏
C.苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液
D.MgCl2溶液(Fe3+):加MgO,过滤
难度: 中等查看答案及解析
-
等质量的铁屑和锌粒与足量的同浓度的稀硫酸反应,下列图象可能正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析