-
人类已经成功合成了117号元素Uus,关于
的叙述正确的是
A.原子内电子数多于中子数 B.与
电子式相同
C.元素的近似相对原子质量是294 D.处于不完全周期内
难度: 简单查看答案及解析
-
正确使用化学用语是学好化学的基础,下列化学用语正确的是
A.
的名称:1,4-二甲苯 B.丙烷的分子式:CH3CH2CH3
C.聚丙烯的链节:—CH2-CH2-CH2— D.H2S的电子式:
难度: 简单查看答案及解析
-
化学在科学、技术、社会、环境中应用广泛,其中原理错误的是
A.利用乙二醇的物理性质作内燃机抗冻剂
B.煤经过气化和液化两个物理变化,可变为清洁能源
C.采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体
D.苦卤经过浓缩、氧化、鼓入热空气或水蒸气,可获得溴
难度: 简单查看答案及解析
-
根据元素在周期表中的位置可以预测
A.分解温度:CH4>H2S B.氧化性:NaClO>Na2SO3
C.同浓度溶液pH:Na2SiO3> Na2CO3 D.金属性:Ca > Na
难度: 简单查看答案及解析
-
分类是重要的科学研究方法,下列物质分类正确的是
A.酸性氧化物:SO2、SiO2、NO2
B.弱电解质:CH3COOH、BaCO3、Fe(OH)3
C.纯净物:铝热剂、漂粉精、聚乙烯
D.无机物:CaC2、石墨烯、HCN
难度: 中等查看答案及解析
-
能够产生如图实验现象的液体是
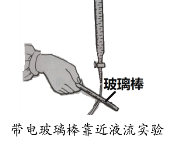
A.CS2 B.CCl4
C.H2O D.
难度: 简单查看答案及解析
-
当冰醋酸固体变成液体或气体时,一定发生变化的是
A.分子内化学键 B.共价键键能
C.分子的构型 D.分子间作用力
难度: 中等查看答案及解析
-
离子化合物O2[PtF6]的阴离子为[PtF6]-,可以通过反应 O2+PtF6→O2[PtF6]得到。则
A.O2[PtF6]中只含离子键 B.O2[PtF6]中氧元素化合价为+1
C.反应中O2是氧化剂,PtF6是还原剂 D.每生成1molO2PtF6 转移1mol电子
难度: 中等查看答案及解析
-
以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
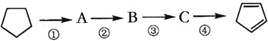
A. A的结构简式是
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明
已完全转化为
难度: 中等查看答案及解析
-
甲、乙两种CH3COOH溶液的pH,若甲比乙大1,则甲、乙两溶液中
A.c(甲) : c(乙) =1:10 B.c(H+)甲: c(H+)乙=1:2
C.c(OH-)甲: c(OH-)乙=10:1 D.α(甲) : α(乙) =2:1
难度: 中等查看答案及解析
-
关于物质检验的下列叙述中正确的是
A.将酸性高锰酸钾溶液滴入裂化汽油中,若紫红色褪去,证明其中含甲苯
B.让溴乙烷与NaOH醇溶液共热后产生的气体通入溴水,溴水褪色,说明有乙烯生成
C.向某卤代烃水解后的试管中加入AgNO3溶液,有淡黄色沉淀,证明它是溴代烃
D.往制备乙酸乙酯反应后的混合液中加入Na2CO3溶液,产生气泡,说明乙酸有剩余
难度: 中等查看答案及解析
-
比较纯碱的两种工业制法,正确的是
选项
项目
氨碱法
联合制碱法
A.
原料
食盐、氨气、生石灰
食盐、氨气、二氧化碳
B.
可能的副产物
氯化钙
氯化铵
C.
循环物质
氨气、二氧化碳
氨气、氯化钠
D.
评价
原料易得、产率高
设备简单、能耗低
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是
A.
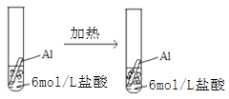
B.
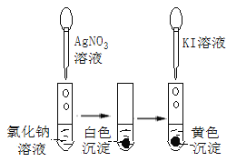
C.
D.
难度: 中等查看答案及解析
-
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?)
2HI(g)+9.48kJ
②H2(g) + I2(?)
2HI(g)-26.48kJ
下列判断正确的是
A.①中的I2为固态,②中的I2为气态
B.②的反应物总能量比①的反应物总能量低
C.①的产物比反应②的产物热稳定性更好
D.1mol 固态碘升华时将吸热17kJ
难度: 中等查看答案及解析
-
某溶液中有S2-、SO32-、Br-、I-四种阴离子各0.1mol。现通入Cl2,则通入Cl2的体积(标准状况)和溶液中相关离子的物质的量的关系图正确的是
A.
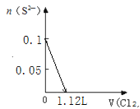 B.
B.
C.
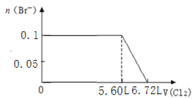 D.
D.
难度: 困难查看答案及解析
-
无法实现的反应是
A.酸和酸反应生成酸 B.只有氧化剂的氧化还原反应
C.盐和盐反应生成碱 D.一种碱通过化合反应生成一种新的碱
难度: 中等查看答案及解析
-
尿素燃料电池既能去除城市废水中的尿素,又能发电。尿素燃料电池结构如下图所示,甲电极上发生如下反应:CO(NH2)2+ H2O-6e-→CO2+N2+6H+,则
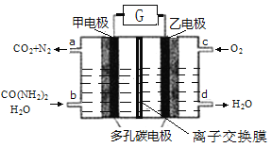
A.甲电极是阴极
B.电解质溶液可以是KOH溶液
C.H+从甲电极附近向乙电极附近迁移
D.每2molO2理论上可净化1molCO(NH2)2
难度: 困难查看答案及解析
-
欲测定Mg(NO3)2•nH2O中结晶水的含量,下列方案中肯定不可行的是
A.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
B.称量样品→加热→冷却→称量Mg(NO3)2
C.称量样品→加热→冷却→称量MgO
D.称量样品→加NaOH溶液→过滤→加热→冷却→称量MgO
难度: 中等查看答案及解析

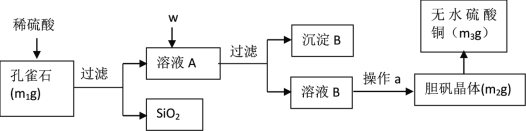
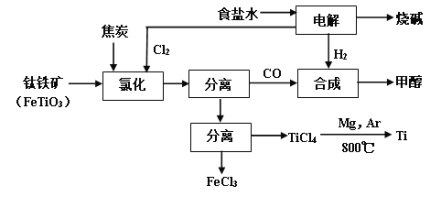

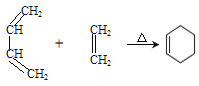
 RCH2CH2OH+
RCH2CH2OH+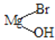
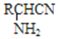
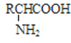

 ,而不是
,而不是 或
或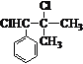 的原因是_________。
的原因是_________。