-
下列仪器中,零刻度在上端的是( )
A.量筒 B.水银温度计 C.滴定管 D.容量瓶
难度: 简单查看答案及解析
-
用重量法测定硫酸铜晶体结晶水含量的实验中,不需要的仪器是( )
A.酒精灯 B.电子天平 C.蒸发皿 D.干燥器
难度: 简单查看答案及解析
-
加热时必须隔着石棉网的是( )
A.烧杯 B.坩埚 C.试管 D.蒸发皿
难度: 简单查看答案及解析
-
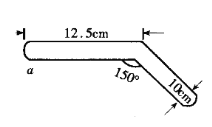
有一支50 mL滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处。把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积( )
A.大于40.0 mL B.等于40.0 mL C.小于40.0 mL D.等于10.0 mL
难度: 简单查看答案及解析
-
右图是盛NaOH溶液的滴定管,液面位置如图所示,则此时的读数为( )
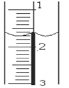
A.1.70 B.1.30 C.0.60 D.1.40
难度: 简单查看答案及解析
-
下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④
C.⑤②③①④ D.②①③⑤④
难度: 简单查看答案及解析
-
在一次实验开放日活动中,某同学取出一无色溶液,向其中滴加酚酞试液后变成红色。该同学作出的下列结论中正确的是( )
A.该溶液能使石蕊试液变成蓝色 B.该溶液的pH小于7
C.该溶液一定是碱溶液 D.该溶液显酸性
难度: 简单查看答案及解析
-
在某溶液中加入甲基橙溶液后呈红色,则下列离子在溶液中不能大量存在的是( )
A.Fe3+ B.Na+ C.Ba2+ D.AlO2-
难度: 中等查看答案及解析
-
有已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作正确的是( )
A.滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入未知浓度的NaOH待测液
C.滴定前没有排出滴定管尖嘴处的气泡
D.读数时视线与滴定管内液体的凹液面最底处保持水平
难度: 中等查看答案及解析
-
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3·nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成。某学生的实验流程如下,以下说法不正确的是( )

A.实验所用定量实验仪器为电子天平
B.灼烧在坩埚中进行
C.操作只在空气中进行冷却
D.流程中有恒重操作
难度: 中等查看答案及解析
-
某次硫酸铜晶体结晶水含量的测定实验中,相对误差为+2.67%,其原因可能是( )
A.晶体为完全变白即停止加热
B.硫酸铜晶体中含有NaCl杂质
C.实验时盛放硫酸铜晶体的容器未完全干燥
D.加热后固体未放入干燥其中冷却
难度: 中等查看答案及解析
-
下列有关几个定量实验的说法,正确的是( )
A.配置溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
B.可用50 mL量筒量取30.00 mL Na2CO3溶液
C.做测定硫酸铜晶体中结晶水含量的实验时,把灼烧后的白色粉末直接放在空气中冷却
D.做测定硫酸铜晶体中结晶水含量的实验时,称量操作至少要有4次
难度: 中等查看答案及解析
-
用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外
A.①③④ B.②⑤ C.②③⑤ D.①③
难度: 中等查看答案及解析
-
可以比较铝和铁的活泼性强弱的实验是( )
A.将在空气中放置已久的这两种块状单质分别放入热水中
B.将两种金属连接后放入稀硫酸中
C.将两种金属分别投入浓硫酸中,观察产生氢气的快慢
D.向含铝离子和亚铁离子的溶液中加入钠,观察谁先析出
难度: 中等查看答案及解析
-
用NaOH溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知NaOH是否过量,判断它是否过量的方法是( )
A.加入5 mL盐酸进行滴定
B.再滴一滴待测盐酸
C.重新进行滴定
D.以上方法均不适用
难度: 简单查看答案及解析
-
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案I:铜铝混合物
测定生成气体的体积
方案II:铜铝混合物
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸
B.溶液A和B均可以是NaOH溶液
C.溶液A和B均只能是盐酸,不可以是NaOH溶液
D.实验室方案II更便于实施
难度: 简单查看答案及解析
-
关于物质性质变化的比较,正确的是( )
①酸性:HClO2 > HBrO3 > HIO3 ②碱性:NaOH > Mg(OH)2 > Al(OH)3
③热稳定性:HCl > H2S > PH3 ④还原性:F- > Cl- > Br-
A.①②④ B.②③④ C.②③ D.①②③④
难度: 中等查看答案及解析
-
用1 mol的钠、镁、铝、铁分别与100 mL 2 mol/L的稀硫酸反应,放出氢气的是( )
A.钠最多 B.铝最多 C.只有镁、铁一样多 D.都一样多
难度: 中等查看答案及解析
-
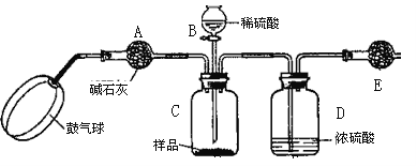
某校化学兴趣小组的同学用如图所示的装置测定空气中氧气的含量,结果最后测得的氧气的体积分数出现了明显的误差。以下不会引起误差的是( )
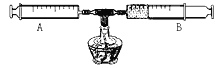
A.铜丝的量不足
B.装置的气密性不好
C.交替缓慢推动两个注射器的活塞
D.没有冷却至室温就读数
难度: 简单查看答案及解析
-
有①②③三瓶体积相等,浓度都是1 mol/L的HCl溶液,将①加热蒸发体积至体积减少一半,在②中加入少量CH3COONa固体,加入后溶液仍呈强酸性,③不作改变。然后以酚酞做指示剂,用NaOH溶液滴定上述三种溶液,可观察到所消耗的NaOH溶液体积是( )
A.①=③>② B.③>②>① C.③=②>① D.①=②=③
难度: 中等查看答案及解析