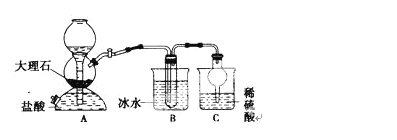
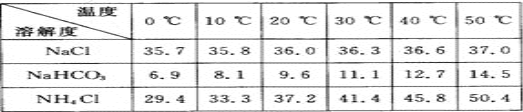
-
下列对有关微粒的相互关系和特征描述正确的是( )
| 选项 | 微粒 | 相互关系 | 特征描述 |
| A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
| B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
| C | 20278Pt、19878Pt | 同素异形体 | 铂作氨催化氧化时的催化剂 |
| D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A.A B.B C.C D.D
-
“分类”的思想方法,在化学发展中起到了重要作用.下列分类标准合理的是 ( )
A.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 B.只含一种元素的物质一定是单质
C.溶于水后能电离出H+的化合物都为酸 D.有单质生成的反应一定是氧化还原反应
-
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.溴和汞的气化 D.二氧化硅和铁分别受热熔化
-
下列物质、类别、用途或储存方法对应关系正确的是( )
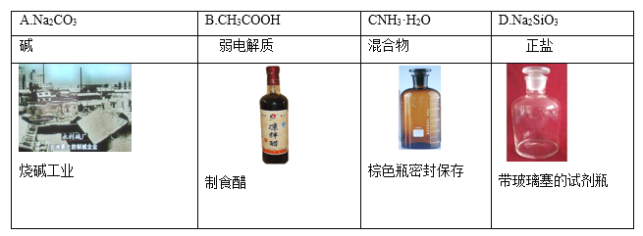
A.A B.B C.C D.D
-
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
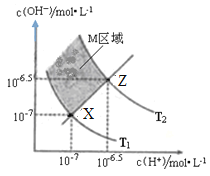
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
-
下列实验过程中,始终无明显现象的是
A. 通入
通入 溶液中 B.
溶液中 B. 通入
通入 溶液中
溶液中
C. 通入
通入 溶液中 D.
溶液中 D. 通入已酸化的
通入已酸化的 溶液中
溶液中
-
物质发生化学反应时,下列量值在反应前后肯定不发生变化的是 ( )
①电子总数;②原子总数; ③分子总数; ④物质的种类;⑤物质的总质量;⑥物质所具有的总能量。
A.①②⑤ B.②⑤⑥ C.①②③⑤ D.①②⑤⑥
-
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.原电池是将电能转化为化学能的一种装置
C.物质的燃烧都是放热反应
D.化学键的形成需吸收能量
-
由乙醇制乙二酸乙二酯最简单的正确流程途径顺序是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦水解反应
A.①②③⑤⑦ B.⑤②⑦③⑥
C.⑤②①③④ D.①②⑤③⑥
-
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
A.A B.B C.C D.D
-
H2A为二元弱酸,则下列说法正确的是
A.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
B.在等物质的量浓度的Na2A、NaHA两溶液中,前者pH大于后者
C.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
D.在Na2A溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
-
按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
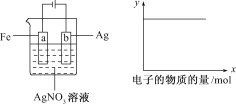
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④
C.①②④ D.①②⑤
-
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是( )
A.T、Q的氢化物常态下均为无色气体
B.L、M的单质与稀盐酸反应速率:M > L
C.R的氧化物对应的水化物可能具有两性
D.L、Q形成的简单离子核外电子数相等
-
已知反应①:CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应
D.对于反应③,恒温恒容下,增大压强,H2浓度一定增大
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol甲苯含有6NA个C-H键
B.25℃,pH =13的NaOH溶液中含有OH-的数目为 0.1NA
C.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
-
已知氧化性Fe3+>I2。向Fe I 2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b I-+c Cl2→d Fe3++ e I2+ f Cl- 。下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2,4,3,2,2,6 B.0,2,1,0,1,2
C.2,0,1,2,0,2 D.2,8,5,2,4,10
-
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
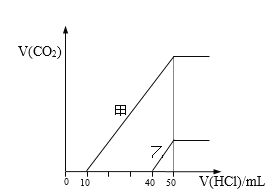
A.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况)
B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+→H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D.原NaOH溶液的物质的量浓度为0.5 mol·L-1
-
下列方程式正确的是( )
A.用铁丝网作电极,电解饱和食盐水:2Cl﹣+2H2O 2OH﹣+Cl2↑+H2↑
2OH﹣+Cl2↑+H2↑
B.Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-→3BaSO4↓+2Al(OH)3↓
C.向H218O中投入Na2O2固体: 2H218O + 2Na2O2→ 4Na+ + 4OH-+ 18O2↑
D.石灰乳中Ca(OH)2的电离:Ca(OH)2(s)  Ca2++ 2OH-
Ca2++ 2OH-
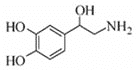
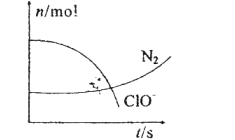
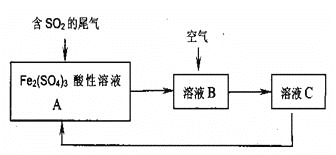




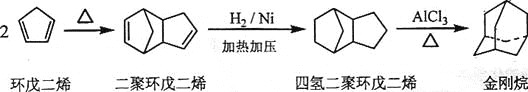
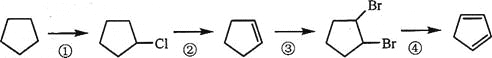
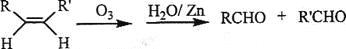
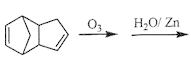 __________;
__________;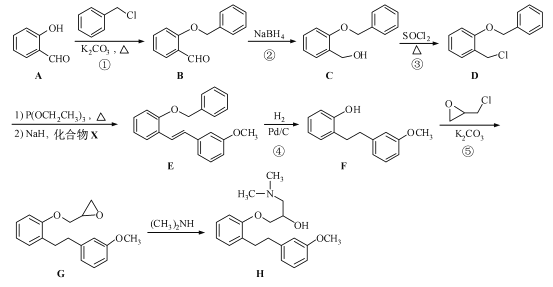
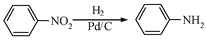 。化合物
。化合物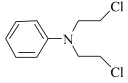 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以