-
短周期主族元素W、X、Y、Z的原子序数依次增大。W原子的最外层电子数是次外层的3倍,X在周期表中位于ⅢA族,Y 与W位于同一主族。下列说法正确的是( )
A. 最简单气态氢化物的热稳定性:W>Y>Z B. 简单离子的半径:X< W< Y
C. 化合物Y2Z2中既含有离子键,又含有共价键 D. 工业上用电解熔融XZ3制备X单质
难度: 中等查看答案及解析
-
下列属于物理变化的是
A.煤的气化 B.天然气的燃烧 C.烃的裂解 D.石油的分馏
难度: 简单查看答案及解析
-
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A. 蚕丝的主要成分是蛋白质
B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应
D. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 乙醇、苯应密封保存,置于阴凉处,且远离火源 B. 金属钠着火时,可用细沙覆盖灭火
C. 有毒药品的废液须倒入指定的容器 D. 容量瓶洗净后须用酒精灯加热干燥
难度: 中等查看答案及解析
-
通过实验得出的结论正确的是
A.将某固体试样完全溶于盐酸,再滴加BaCl2溶液,出现白色沉淀,则该固体试样中存在SO42-
B.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,则该固体试样中不存在Fe3+
C.在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH4+
D.在某固体试样加水后的上层清液中,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,则该固体试样中存在SiO32-
难度: 中等查看答案及解析
-
有共价键的离子化合物是
A.CaCl2 B.H2SO4 C.NH4Cl D.SiC
难度: 简单查看答案及解析
-
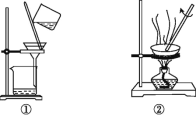
下列图示与操作名称不对应的是
A. 升华
 B. 分液
B. 分液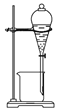
C. 过滤
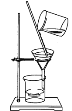 D. 蒸馏
D. 蒸馏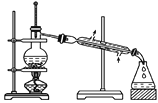
难度: 中等查看答案及解析
-
下列属于有机物,又是非电解质的是
A.纯碱 B.乙酸 C.葡萄糖 D.甘氨酸
难度: 简单查看答案及解析
-
下列物质的名称不正确的是
A.Na2CO3:纯碱 B.FeSO4:绿矾
C.
 :丙三醇 D.
:丙三醇 D.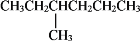 :3−甲基己烷
:3−甲基己烷难度: 简单查看答案及解析
-
下列表示不正确的是
A.次氯酸的电子式
B.丁烷的球棍模型
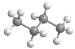
C.乙烯的结构简式CH2=CH2 D.CO2的结构式:O=C=O
难度: 简单查看答案及解析
-
下列说法不正确的是
A.
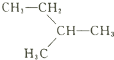 的名称为2一甲基丁烷
的名称为2一甲基丁烷B.
和
为同一物质
C.
和
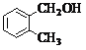 互为同系物
互为同系物D.H2NCH2COOCH3和CH3CH2CH2NO2是同分异构体
难度: 简单查看答案及解析
-
下列说法正确的是
A.二氧化硅导电能力强,可用于制造光导纤维
B.铁锈的主要成分可表示为Fe2O3
C.钙单质可以从TiCl4溶液中置换出Ti
D.不能用H2还原MgO制备单质Mg
难度: 中等查看答案及解析
-
下列有关实验操作,说法正确的是
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水会导致溶液浓度偏低
B. 用盐酸标准溶液滴定未知浓度氨水,选用酚酞做指示剂的结果比甲基橙更准确
C. 测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却
D. 测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度
难度: 简单查看答案及解析
-
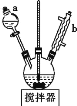
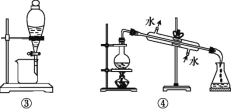
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
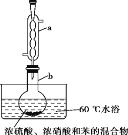
A.水浴加热的优点是使反应物受热均匀、容易控制温度
B.反应完全后,可用仪器a、b蒸馏得到产品
C.实验过程中若发现仪器b中未加入碎瓷片,可冷却后补加
D.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸, 待冷却至室温后,将所得混合物加入苯中
难度: 中等查看答案及解析
-
下列有关实验说法,不正确的是
A.在层析实验中,通常以滤纸作为惰性支持物,吸附水作为固定相
B.可用精密pH试纸区分pH=5.1和pH=5.6的两种NH4Cl溶液
C.结晶时,若溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体颗粒就越细小
D.火柴头的浸泡液中滴加AgNO3溶液、稀HNO3和NaNO2溶液,可检验火柴头是否含有氯元素
难度: 中等查看答案及解析
-
不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-===2Mn2++5SO42-+4H+
B.FeCl3溶液腐蚀铜板:2Fe3++Cu===2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2
+CO2+H2O====2
+CO32-
D.酸性碘化钾溶液中滴加适量双氧水:2I−+2H++H2O2===I2+2H2O
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
难度: 简单查看答案及解析
-
下列关于
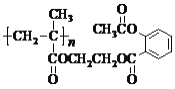 的说法,不正确的是
的说法,不正确的是A.该物质可由n个单体分子通过缩聚反应生成
B.0.1 mol该物质完全燃烧,生成33.6 n L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1 mol该物质与足量NaOH溶液反应,最多可消耗4n mol NaOH
难度: 中等查看答案及解析
-
下列说法正确的是
A.油脂、糖类和蛋白质都能发生水解反应
B.油脂皂化反应可用酸作催化剂
C.淀粉溶液中加入硫酸,加热4-5min,再加入少量银氨溶液,加热,有光亮银镜生成
D.羊毛、蚕丝、塑料、合成橡胶都属于有机高分子材料
难度: 简单查看答案及解析
-
已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L−1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
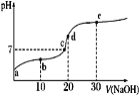
A.a点溶液的c(H+)=4×10-4mol·L-1
B.水电离程度:e>d>c>b>a
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.d点:c(OH-)=c(CH3COOH)+c(H+)
难度: 中等查看答案及解析
-
某恒定温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A (g)+2B (g)⇌4C (?)+2D (?),“?”代表状态不确定。反应一段时间后达到平衡,测得生成 1.6 mol C,且反应前后压强之比为5:4,则下列说法正确的是
A.增加C,B的平衡转化率不变
B.此时B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.该反应的化学平衡常数表达式是K=
难度: 中等查看答案及解析
-
微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
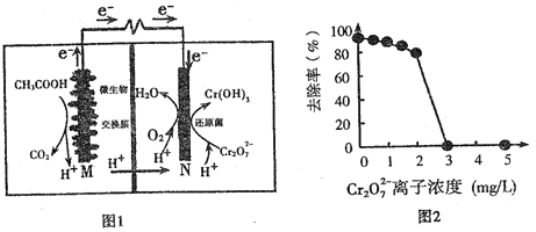
A.M为电池正极,CH3COOH被还原
B.外电路转移4mol电子时,M 极产生22.4LCO2
C.反应一段时间后,N极附近的溶液pH下降
D.Cr2O72-离子浓度较大时,可能会造成还原菌失活
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.32 g S8(分子结构:
 )中的共价键数目为NA
)中的共价键数目为NAB.1L、0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA个
C.标准状况下,22.4LHF含NA个分子
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
难度: 简单查看答案及解析
-
下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H = -38.6kJ•mol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJ•mol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJ•mol-1,则O2比O3稳定
难度: 中等查看答案及解析
-
过二硫酸(H2S2O8)可以看成是H2O2中两个氢原子被二个磺基(-SO3H)取代的产物,下列说法不正确的是
A.H2S2O8中硫的化合价为+7价,具有强氧化性
B.H2S2O8中具有强酸性和不稳定性
C.Na2S2O8能水解,水溶液呈碱性
D.Na2S2O8可氧化Fe2+、I-等还原性微粒
难度: 简单查看答案及解析

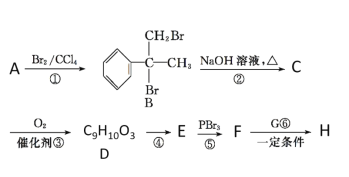
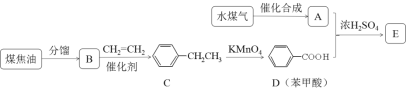
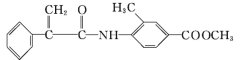 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示: