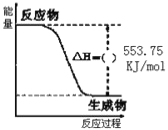
-
分析下列反应,在任何温度下均能自发进行的是
A. 2N2(g)+ O2(g)=2N2O(g) △H>0 B. Ag(s)+ 1/2Cl2(g)=AgCl(s) △H<0
C. HgO(s) =Hg(1)+ 1/2O2(g) △H>0 D. H2O2(l)=1/2O2(g)+H2O(l) △H<0
难度: 简单查看答案及解析
-
下列关于“一定”说法正确的句数是
①pH=6的溶液一定是酸性溶液。
②c(H+)>c (OH-)一定是酸性溶液。
③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力。
④25 ℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14。
⑤如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑥0.2mol/L氢硫酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响
⑧使用pH试纸测定溶液pH时若先润湿,则测得溶液的pH一定有影响
A.0句 B.1句 C.2句 D.3句
难度: 中等查看答案及解析
-
“一次能源与二次能源”的叙述中正确的是( )
①直接从自然界中取得的能源都是一次能源
②二次能源是由一次能源加工、转换而得到
③太阳能、风能、地热能、氢能等都是一次能源
④煤、石油、天然气等化石能源都是一次能源
⑤电能是一种应用最广、污染最小的二次能源
⑥蒸汽能、机械能、水电、核电等都是二次能源
A.①②③⑤ B.①③④⑥ C.①②④⑤⑥ D.②③④⑤⑥
难度: 简单查看答案及解析
-
下列说法正确的是
A.非自发反应一定不能实现
B.同种物质气态时熵值最小,固态时熵值最大
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H <0
D.恒温恒压下,△H <0且△S>0的反应一定不能自发进行
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.在水溶液中或熔融状态下能电离出自由移动的离子的化合物是电解质
B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C.CO2的水溶液导电能力很弱,所以CO2是弱电解质
D.强电解质溶液的导电性一定强于弱电解质溶液的导电性
难度: 简单查看答案及解析
-
已知热化学方程式C2H2(g)+
O2(g)=2CO2(g)+H2O(g) △H=-1256kJ/mol,下列说法正确的是( )
A.乙炔的燃烧热为1256kJ·mol-1
B.若生成2mol液态水,则放出的热量为2512 kJ·mol-1
C.若转移10mol电子,则消耗2.5mo1 O2
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
难度: 简单查看答案及解析
-
已知:①2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③2H2(g)+O2(g)===2H2O(l) ΔH3
④2H2(g)+O2(g)===2H2O(g) ΔH4
⑤CO(g)+2H2(g)===CH3OH(g) ΔH5
下列关于上述反应焓变的判断正确的是
A.ΔH1>0,ΔH2<0 B.ΔH3>ΔH4
C.ΔH1=ΔH2+2ΔH3-ΔH5 D.2ΔH5+ΔH1<0
难度: 困难查看答案及解析
-
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是
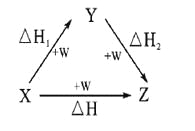
①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
难度: 中等查看答案及解析
-
对于有气体参加的化学反应,下列说法正确的是( )
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数增大,化学反应速率一定增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大
难度: 简单查看答案及解析
-
常温下,加水冲稀时c(H+)/c(OH-)的值明显减小的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO
、CH3COO- ②Na+、Fe2+、I-、SO
③Ba2+、Cl-、NO
、Na+ ④Na+、Ca2+、Cl-、HCO
⑤K+、SO
、Cl-、NO
A. ①③⑤ B. ②③ C. ②④ D. ②③⑤
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是

A.该反应的△H>0
B.在T2时,若 反 应 体 系 处于 状 态D ,则 此 时v正>v逆
C.若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.工业合成氨时采用铁触媒作反应的催化剂
C.工业生产硫酸的过程中使用过量的空气以提高SO2的转化率
D.将收集NO2气体的烧瓶密闭后放在装有热水的烧杯中,发生颜色变化
难度: 中等查看答案及解析
-
对于反应:4CO(g)+2NO2(g)
4CO2(g)+N2(g) △ H=-1200 kJ·mol-1,温度不同 (T2>T1),其他条件相同时,下列图像正确的是( )
A.
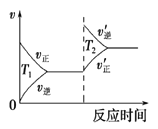 B.
B.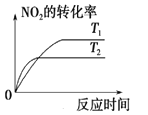 C.
C.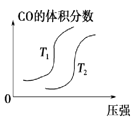 D.
D.
难度: 中等查看答案及解析
-
可逆反应mA(固)+nB(气)
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
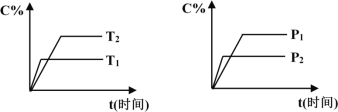
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
难度: 简单查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45mol⋅L-1⋅min-1 ②v(B)=0.6mol⋅L-1⋅s-1③v(C)=0.4mol⋅L-1⋅s-1④v(D)=0.45mol⋅L-1⋅s-1,该反应进行的快慢顺序为( )
A.④<③=②<① B.④>③=②>① C.①>②>③>④ D.④>③>②>①
难度: 中等查看答案及解析
-
学习“化学平衡移动原理”后,以你的理解,下列叙述正确的是
A.对于已达平衡的体系,改变影响化学平衡的条件,不可能出现v正增大,v逆减小的情况。
B.对2HI
H2+I2(g),平衡体系增加压强使颜色变深,可用勒夏特列原理解释。
C.升高温度,一定会使化学平衡发生移动。
D.在盛有一定量NO2的注射器中,向外拉活塞,其中气体颜色先变浅再变深,甚至比原来深。
难度: 简单查看答案及解析
-
关于可逆反应A(s)+ +B(g)
2C(g);△H<0,平衡常数为K,下列说法正确的是
A.K=c2(C)/c(A)×c(B)
B.K值越大表示达到平衡时,正反应进行程度越大
C.其它条件不变时,温度升高,K值增大
D.其它条件不变时,压强减小,K值减小
难度: 中等查看答案及解析
-
根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
选项
A
B
C
D
图像

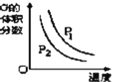


反应
aX(g)+bY(g)⇌cZ(g)
L(s)+aG(g)⇌bR(g)
aA+bB⇌cC
A+2B⇌2C+3D
操作或条件
密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体,D为固体或液体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
可逆反应:2A(s)
B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
A.①③④⑤⑥ B.①③④⑥ C.①④⑥ D.全部
难度: 中等查看答案及解析
-
醋酸的电离方程式为CH3COOH(aq)
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+)·c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B.向该溶液中加少量CH3COONa固体,平衡正向移动
C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D.升高温度,c(H+)增大,Ka变大
难度: 简单查看答案及解析
-
25℃时, pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是
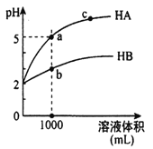
A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
难度: 中等查看答案及解析
-
常温下,关于溶液的稀释说法正确的是
A.将1 L 0.1mol·L-1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol·L-1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
难度: 简单查看答案及解析
-
1molA与1molB混合于1L的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g),2s后A 的转化率为 50%,测得v(D)=0.25 mol/(L∙s),下列推断不正确的是
A.z=2 B.2s时,容器内的压强是初始的7/8倍
C.2s 时C的体积分数为2/7 D.2s时,B的浓度为0.5mol/L
难度: 简单查看答案及解析
-
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应: A(g)+xB(g)
2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
难度: 中等查看答案及解析
-
在一定条件下,向密闭容器中加入一定量的C(s)与H2O(g)发生可逆反应C(s) + H2O(g)
CO(g) + H2(g),反应达到平衡后C(s)与H2O(g)转化率为2:1关系,则下列说法正确的是
A.开始加入的C(s)与H2O(g)物质的量为2:1
B.若增大压强,H2O(g)转化率不变化
C.达到平衡后混合气体平均式量可能为16
D.开始反应后混合气体平均式量一直减小
难度: 中等查看答案及解析