-
任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:H2O⇌H++OH-。请回答下列有关问题:
(1)现欲使水的电离平衡向右移动,且所得溶液呈酸性,可以选择的方法有_________。
A.加热至100℃ B.加入 NaHSO4(s) C.加入CH3COONa(s) D.加入NH4Cl(s)
(2)在t℃时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积为_____,此温度____25℃(选填“大于”“小于”或“等于”),理由是________。
(3)在25℃时,将pH=a的NaOH溶液VaL与pH=b的HCl溶液VbL混合,请填写下列空白:
①若所得溶液呈中性,且a=11,b=3,则Va:Vb=__________。
②若所得溶液呈中性,且Va:Vb=10:1,则a+b=__________。
③若所得混合溶液的pH=10,且a=12,b=2,则 Va: Vb=___________。
④若将pH=12的NaOH溶液VaL与VbL水混合后所得溶液的pH=10,则Va:Vb=____。
高二化学综合题困难题查看答案及解析
-
已知溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)水存在如下平衡:H2O+H2O
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
(2)向水中加NaHCO3固体,水的电离平衡向____(填“左”或“右”)移动,且所得溶液显____ 性。
(3)常温下,0.1 mol·L-1 CH3COONa溶液的pH为9,则由水电离出的c(H+)=________。
(4)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m____n ( 填“>”“<”或“=”)。
高二化学填空题中等难度题查看答案及解析
-
常温下,Na2CO3溶液中存在平衡:
+H2O
+OH-,下列有关该溶液的说法正确的是
A. Na2CO3在水解过程导致碳酸钠电离平衡被促进
B. 升高温度,平衡向右移动
C. 滴入CaCl2浓溶液,溶液的pH增大
D. 加入NaOH固体,溶液的pH减小
高二化学单选题中等难度题查看答案及解析
-
电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质
NH3.H2O
HCOOH
HCN
H2CO3
电离常数(25℃)
Kb = 1.8×10 −5
Ka = 1. 77×10 −4
Ka=4.3×10−10
Ka1=5.0×10−7
Ka2=5.6×10−11
① 已知25℃时,HCOOH( aq) +OH −( aq)=HCOO−(aq) +H2O(l) △H=−a kJ/mol H+(aq) +OH−(aq) =H2O(l) △H=−b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN−)______c(HCO3 −)(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2−) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
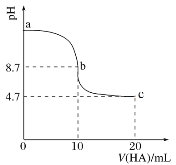
① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 mol•L-1NaOH和n mol•L-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
高二化学综合题困难题查看答案及解析
-
下列对氨水溶液中存在的电离平衡NH3·H2O
NH4++OH-叙述正确的是( )
A. 加水后,溶液中n(OH-)增大
B. 加入少量浓盐酸,溶液中c(OH-)增大
C. 加入少量浓NaOH溶液,电离平衡正向移动
D. 加入少量NH4Cl固体,溶液中c(NH4+)减少
高二化学单选题中等难度题查看答案及解析
-
对氨水溶液中存在的电离平衡NH3•H2O⇌NH4++OH-,下列叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中n(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)减少高二化学选择题中等难度题查看答案及解析
-
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3 溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
高二化学填空题困难题查看答案及解析
-
(14分)常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式 ﹑ 。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH= ;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式: ;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH= 。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= 。该温度下(t℃),0.1 mol·L-1HCl溶液的pH= ;
高二化学填空题中等难度题查看答案及解析
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、 、 。(填写微粒符号)
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液①NH4NO3、②NaCl、③NaClO、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为 。(填写溶液的序号)
(3)常温时,AlCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl、② (NH4)2SO4、 ③NH3·H2O ④ (NH4)2CO3 、⑤ NH4HSO4。溶液中c(NH4+)从大到小的顺序为: 。(填写溶液的序号)
高二化学填空题简单题查看答案及解析
-
(10分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为________。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
高二化学填空题简单题查看答案及解析