-
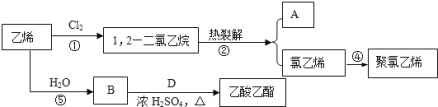
下列反应中前者属于取代反应,后者属于加成反应的是( )
A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色
B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C.苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应
D.在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应
难度: 简单查看答案及解析
-
下列说法不正确的是
A.12C和14C互为同位素
B.甲烷与正丁烷(CH3CH2CH2CH3)互为同系物
C.二氧化碳和干冰互为同素异形体
D.乙醇(CH3CH2OH)与二甲醚(CH3-O-CH3)互为同分异构体
难度: 中等查看答案及解析
-
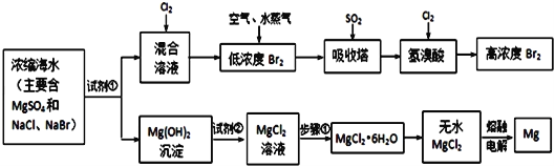
合理开发和利用海水资源是世界各国研究的课题。下列对于海水利用的认识错误的是
A.海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺
B.淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
C.可以用太阳能电解海水以获取氢能源
D.以海水中提纯出的NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
难度: 简单查看答案及解析
-
“高铁出口”是中国的骄傲,高铁产业的发展也给铝工业带来了春天。最近,某大学的超导回旋加速器实验室发现了超重铝42Al,关于42Al的说法错误的是
A.属于金属元素 B.中子数与质子数之差为29
C.原子的核外电子数为13 D.27Al和42Al是两种不同的核素
难度: 简单查看答案及解析
-
下列变化中主要属于化学变化的是
①风化 ②皂化 ③酯化 ④煤的气化 ⑤煤的液化 ⑥裂化 ⑦裂解 ⑧蒸馏 ⑨分馏 ⑩煤的干馏
A.①②③④⑤⑥⑦⑩ B.①②③⑥⑦⑧⑨⑩
C.①②③⑥⑦⑩ D.①②③④⑤⑥⑦
难度: 简单查看答案及解析
-
化学在环境、生产和生活中有着广泛的应用。下列说法中正确的是
A.普通锌锰干电池不含环境污染物,可以随意丢弃
B.海带中含有I-可用H2O2将其氧化成I2再用裂化汽油进行萃取
C.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染
D.工业可用电解熔融的Al2O3或AlCl3制取单质铝
难度: 简单查看答案及解析
-
运用有关概念判断下列说法中不正确的是
①由元素周期律的变化规律可知:SrSO4的溶解度比CaSO4的溶解度大
②同位素的性质完全相同
③利用Br2与I2分别与足量的H2反应的难易,判断溴与碘的非金属活动性强弱
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥互称同位素的两种核素间具有相同的中子数和核外电子数
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
难度: 中等查看答案及解析
-
下列化学用语表达正确的是
A.羧基的电子式:
B.乙烯的最简式:CH2
C.次氯酸的电子式:
D.四氯化碳的比例模型:

难度: 简单查看答案及解析
-
下列做法利用了浓度对化学反应速率的影响的是
A.将食物保存在电冰箱里 B.做粉尘爆炸实验时选用很细的面粉
C.向过氧化氢溶液中加入MnO2 D.铁与稀盐酸反应太慢时加入较浓的盐酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.只含有一种元素的物质一定是纯净物
B.含有共价键的化合物一定是共价化合物
C.石墨转变为金刚石为化学变化
D.水很稳定是因为水分子间存在较强的分子间作用力
难度: 中等查看答案及解析
-
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A.纤维素
葡萄糖
CO2和H2O(释放能量维持生命活动)
B.淀粉
葡萄糖
CO2和H2O(释放能量维持生命活动)
C.蛋白质
氨基酸
人体所需的蛋白质(人体生长发育)
D.油脂
甘油和高级脂肪酸
CO2和H2O(释放能量维持生命活动)
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法不正确的是
A.1 mol苯分子中含有C=C双键数目为3NA
B.标准状况下,11.2 L CH3Cl中含有的共价键数目为2NA
C.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
D.17 g甲基(﹣14CH3)所含中子数为8NA
难度: 简单查看答案及解析
-
欲除去下列物质中混入的少量杂质(括号内为杂质),所选试剂和分离方法都正确的是
A.乙烷(乙烯):酸性高锰酸钾溶液 洗气 B.溴苯(Br2):NaOH溶液 分液
C.乙醇(水):生石灰 过滤 D.乙醇(乙酸):饱和Na2CO3溶液 分液
难度: 简单查看答案及解析
-
某有机物的结构简式如图,下列关于该有机物的叙述不正确的是
A.该有机物能使Br2的CCl4溶液褪色,但不能使酸性KMnO4溶液褪色
B.1mol该物质与H2发生加成反应,最多可消耗H2 4mol
C.在一定条件下,能发生取代、加成、氧化、酯化和加聚反应
D.能发生酯化反应的有两个官能团
难度: 简单查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为前四周期元素,这四种元素的原子最外层电子数之和为22。下列说法错误的是
X
Y
W
Z
T
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.物质W3X4中,每个原子最外层均达到8电子稳定结构
C.X、Y和氢形成的化合物中可能既有离子键、又有共价键
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
难度: 简单查看答案及解析
-
下列实验方案中,不能达到相应实验目的的是
A
B
C
D
方案
目的
验证不同催化剂对化学反应速率的影响
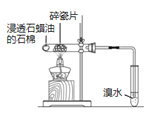
验证石蜡油分解的产物中含有与烷烃性质不同的烃
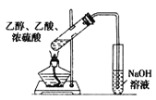
制备乙酸乙酯
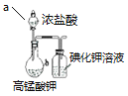
比较Cl2、I2的氧化性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质
丙烷
氧气
水
二氧化碳
X
反应前质量/g
4.4
12.8
0
0
0
反应后质量/g
0
0
7.2
4.4
a
下列判断正确的是
A.表中a的值为5.6
B.X可能是该反应的催化剂
C.X可能含有氢元素
D.X只含碳元素
难度: 简单查看答案及解析
-
在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.6
16.8
22.4
26.5
29.9
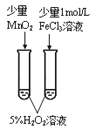
A.该反应可用MnO2、FeCl3溶液作为催化剂
B.0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C.0~10 min,过氧化氢的分解速率逐渐加快
D.反应到6 min时,H2O2分解了50%
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)⇌2AB(l)的能量变化如图所示,判断下列叙述中正确的是
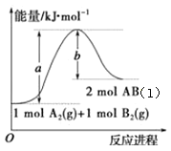
A.每生成2mol气态AB吸收b kJ热量
B.向密闭容器中充入1mol A2和1mol B2充分反应,吸收的热量为(a-b)kJ
C.向密闭容器中充入一定量的A2和B2,生成2mol AB(g),吸收的热量小于(a-b)kJ
D.AB(l)分解为A2(g)和B2(g)的反应为放热反应
难度: 中等查看答案及解析
-
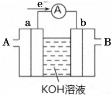
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。关于该电池的叙述正确的是( )
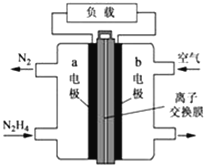
A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣=N2↑+4H2O
难度: 中等查看答案及解析