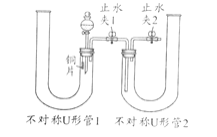
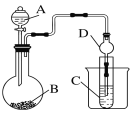
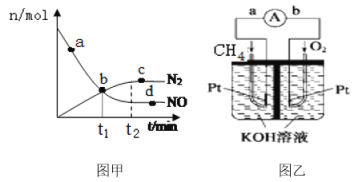
-
化学与科技、社会、生产、生活密切相关。下列有关说法错误的是
A.一些橡胶或塑料制品中要添加抑制剂是为了减缓橡胶塑料制品的老化速率
B.沼气属于生物质能,生物质能是可再生的能源
C.硅胶袋加入到袋装食品中起到脱氧剂的作用
D.面粉生产厂要求严禁烟火是因为面粉有机物颗粒极小、总表面积巨大容易被引燃爆炸
难度: 简单查看答案及解析
-
迄今距门捷列夫提出元素周期表已经151年。根据元素周期表和元素周期律,判断下列叙述不合理的是
A.位于第五周期的元素中主族序数大于周期数的元素为非金属元素
B.第35号元素的单质在常温常压下是液体
C.周期表中元素种类最多的一个族是第Ⅷ族
D.锗元素位于元素周期表中金属与非金属交界线附近
难度: 简单查看答案及解析
-
下列有关说法错误的是
A.一定条件下石墨转化为金刚石反应吸热说明石墨比金刚石稳定
B.化学反应必然伴随发生能量变化
C.化学键是一种作用力
D.不同元素组成的多原子分子中的化学键一定是极性键
难度: 简单查看答案及解析
-
已知反应8NH3+ 3Cl2 = N2+ 6NH4Cl,则下列说法错误的是
A.该反应为置换反应
B.被氧化的NH3被还原的Cl2的物质的量之比为 2:3
C.若该反应转移电子3 mol,则消耗氯气体积33.6 L
D.N2为该反应的氧化产物
难度: 简单查看答案及解析
-
下列性质描述错误的是
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.卤族元素随质子数增加其单质密度逐渐增大
D.碱金属元素随质子数增加其单质熔点逐渐增大
难度: 简单查看答案及解析
-
钡和铊均在周期表中位于第六周期,铊与铝是同族元素,元素符号是Tl;钡与镁是同族元素以下对钡和铊的性质的推断错误的是
A.钡和铊是易导电的银白色金属 B.钡能与水常温下反应生成氢气
C.Tl3+的氧化能力比Al3+弱 D.Tl(OH)3是两性氢氧化物
难度: 中等查看答案及解析
-
下列有关说法错误的是
A.食物中的营养物质主要包括:糖类、油脂、蛋白质、维生素、无机盐和水
B.燃烧相同体积的管道煤气(主要成分CO和H2)和天然气,管道煤气消耗氧气体积大
C.油脂没有固定的熔沸点,是食物中产生能量最高的营养物质
D.金属钠和碳酸钠溶液都可以用来区分乙醇、乙酸和苯
难度: 简单查看答案及解析
-
含氯消毒剂是新冠肺炎疫情期间防疫的一种重要消毒剂,下列说法正确的是
A.用电子式表示HCl的形成过程
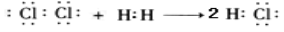
B.次氯酸的结构式 H-O-Cl
C.氯离子的结构示意图
D.
Cl这种核素的原子中有17个中子
难度: 简单查看答案及解析
-
已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
难度: 中等查看答案及解析
-
工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
难度: 简单查看答案及解析
-
在一个不传热的固定容积的容器中,对于反应 A(g)+2B(g)
3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
①体系的温度不再变化 ②外界条件不变时,A、B、C浓度保持不变 ③气体平均分子量不再变化 ④体系的压强不再变化 ⑤气体密度不再变化 ⑥3 v正(B)=2 v逆(C) ⑦单位时间内消耗1 mol A(g)的同时生成3 mol C(g)
A.①②⑥ B.①②③⑤ C.②③④⑤ D.①②④⑤⑦
难度: 简单查看答案及解析
-
下列关于如图所示原电池装置的叙述中,正确的是
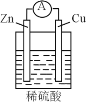
A.铜片是负极
B.电流从锌片经导线流向铜片
C.硫酸根离子在溶液中向正极移动
D.锌电极上发生氧化反应
难度: 简单查看答案及解析
-
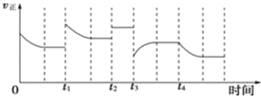
恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:2X(g) + Y(g)
3Z(g),Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是
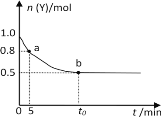
A.t0 min时,n(Z)=0.75 mol
B.0~5min内,以X表示的化学反应速率是0.02 mol·L-1·min-1
C.正反应速率a点比b点大
D.b点时该反应达到了最大限度,反应停止
难度: 中等查看答案及解析
-
下列反应过程中的能量变化与图一致的是
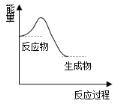
A.2H2O
2H2↑ + O2↑
B.在加热条件下氢气还原氧化铜
C.胆矾受热分解
D.铝热反应
难度: 简单查看答案及解析
-
科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
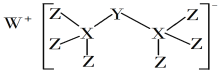
A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
难度: 中等查看答案及解析