-
某主族元素的原子,M层上有一个半充满的能级,这种原子的质子数是( )
A.只能是7 B.只能是15 C.是11或15 D.是11或13
难度: 简单查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子比为1:1的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
难度: 简单查看答案及解析
-
下列原子的价电子排布中,对应元素第一电离能最大的是( )
A. 3s23p1 B. 3s23p2 C. 3s23p3 D. 3s23p4
难度: 简单查看答案及解析
-
下列分子或离子中,不存在sp3杂化类型的是:
A.H2O2 B.NH3 C.C2H6 D.SO2
难度: 中等查看答案及解析
-
某元素原子的质量数为84,原子核内的中子数为48,它的N能层上的电子数为
A.32 B.18 C.8 D.6
难度: 中等查看答案及解析
-
某元素的外围电子构型是3d64s2,下列对该元素的说法中错误的是
A.位于周期表中第四周期Ⅷ族 B.只有2个价电子
C.+3价离子比+2价离子的氧化性强 D.其单质常温下难溶于浓硝酸
难度: 中等查看答案及解析
-
若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了
A.能量最低原则 B.泡利不相容原理
C.洪特规则 D.能量守恒原理
难度: 简单查看答案及解析
-
下列说法中不正确的是
A.σ键比π键的电子云重叠程度大,形成的共价键强
B.s-sσ键与s-pσ键的电子云形状对称性相同
C.丙烯(CH3—CH=CH2)分子有8个σ键,1个π键,其中碳原子分别是sp2、sp3杂化
D.N2分子中有一个σ键,2个π键;NH4+中4个N-H键的键能不相同
难度: 中等查看答案及解析
-
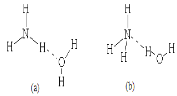
已知磷酸分子
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是
A.
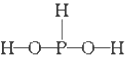 B.
B.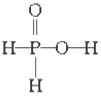 C.
C. D.
D.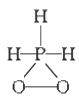
难度: 中等查看答案及解析
-
下列有关化学用语错误的是
A.H2O电子式为:
B.某元素原子(R)的轨道排布式:
C.Ca2+离子基态电子排布式为:1s22s22p63s23p6
D.钾(K)原子的原子结构示意图为:
难度: 简单查看答案及解析
-
下列说法中正确的是
A.所有元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能和电负性值都是最大
D.氮、氧、氟的原子半径小,电负性值大,与氢形成的共价键极性强,容易形成氢键
难度: 中等查看答案及解析
-
下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中S原子和氟原子均满足最外层8电子稳定结构
D.SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
难度: 中等查看答案及解析
-
已知元素
的原子外围电子排布式为
,则元素
的原子序数为( )
A.9 B.10 C.17 D.18
难度: 简单查看答案及解析
-
下列说法正确的是
A.向盛有硫酸铜溶液的试管里加入过量氨水,将得到深蓝色的[Cu(NH3)4]SO4·H2O沉淀
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键,其立体构形都是正四面体
难度: 中等查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.SO3 与SO2 B.BF3 与NH3 C.BeCl2与SCl2 D.H2O 与SO2
难度: 中等查看答案及解析
-
短周期元素X的原子最外电子层中具有最多的未成对电子,元素Y的价电子排布式为nsnnpn+2,则X、Y组成的微粒中,不可能存在的是
A.X2Y5 B.XY42- C.XY2- D.XY3-
难度: 中等查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是
A.CS2、H2S B.BF3、CH4 C.C60、C2H4 D.NH3、HCl
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,没有任何现象,因为[Cu(NH3)4]2+与乙醇不反应
D.在[[Cu(NH3)4]2+离子中,Cu2+提供孤电子对,NH3提供空轨道
难度: 中等查看答案及解析
-
下列说法中正确的是
①外围电子构型为nsnnpn的原子形成的化合物的种类最多; ②在硫酸铜氨溶液中加入乙醇有深蓝色晶体析出; ③H2O是一种非常稳定的化合物,这是由于H2O分子间存在氢键所致; ④P4、BF3、CH3Cl三种分子中所有原子的最外层均满足8e-稳定结构; ⑤乙醇分子中只含σ键. ⑥键角是描述分子立体结构的重要参数,键长的大小与成键原子的半径和成键数目有关,键能越大,键长越长,共价化合物越稳定
A.①③⑤正确 B.③④⑥正确 C.①②⑤正确 D.⑤正确,其他均不正确
难度: 中等查看答案及解析
-
下列化合物中含有2个手性碳原子的是 ( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
难度: 中等查看答案及解析
-
下列说法正确的是
A.HF、HCl、HBr、HI的熔沸点、还原性都依次升高(增强)
B.通常测定氟化氢的相对分子质量大于理论值,因分子间存在氢键
C.BF3、NCl3、PCl5分子中所有原子都满足最外层为8电子结构的是NCl3、PCl5
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
难度: 中等查看答案及解析
-
如下图,关于两分子的说法正确的是
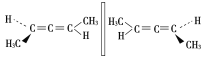
A.互为手性异构体 B.含有手性碳原子
C.两者不是同分异构体 D.互为同系物
难度: 简单查看答案及解析
-
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
元素代号
X
Y
Z
W
N
原子半径/nm
0.186
0.074
0.102
0.099
0.160
主要化合价
+1
-2
-2、+6
+7、-1
+2
A.X 与W形成的化合物是共价化合物
B.常温下单质与水反应速率:X > N
C.最高价氧化物对应水化物酸性:W > Z
D.X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物
难度: 中等查看答案及解析
-
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )
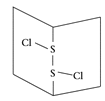
A.S2Cl2的电子式为
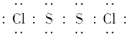
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
难度: 中等查看答案及解析