-
下列叙述中,一定能判断化学平衡移动的是
A. 混合物中各组分的浓度改变
B. 正、逆反应速率改变
C. 混合物中各组分的百分含量改变
D. 混合体系的压强改变
难度: 中等查看答案及解析
-
下列说法错误的是
A.葡萄糖作为人类重要的能量来源,是由于它能发生水解
B.甲醛的水溶液具有防腐性能,是由于它可使蛋白质变性
C.纤维素能通过酯化反应得到醋酸纤维素,是由于纤维素分子中含有羟基
D.“地沟油”经过加工处理后,可以用来制生物柴油和肥皂
难度: 简单查看答案及解析
-
下列有关物质的表达式不正确的是
A.1,3-丁二烯的分子式:C4H6 B.乙烯球棍模型:
C.甲醛的结构式:
D.乙炔的电子式:
难度: 简单查看答案及解析
-
下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:
+ Br2
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH
 CH2=CH2↑+H2O
CH2=CH2↑+H2OD.少量苯酚与浓溴水的反应:
+3Br2
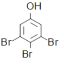 ↓+3HBr
↓+3HBr难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列结论中正确的是
A.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
B.200mL0.5mol/LNa2CO3溶液中,CO32-数目为0.1NA
C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4)
D.一定温度下,反应MgCl2(l)=Mg(1)+Cl2(g)的△H>0,△S>0
难度: 中等查看答案及解析
-
下列说法表达错误的是
A.中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响
B.“NO2球”浸入冷水中颜色变浅:2NO2(g)(红棕色)
N2O4(g)(无色)ΔH<0
C.在酸碱中和滴定实验中,装标准液的滴定管若不润洗,则实验结果偏高
D.甲烷的燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)==CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1
难度: 中等查看答案及解析
-
羟基苯甲酸乙酯是一种常见食品防腐剂,结构如图所示,下列说法错误的是
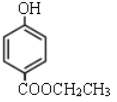
A.该物质易溶于乙醇等有机溶剂
B.该物质属于芳香族化合物
C.该物质中所有碳原子一定共平面
D.1mol该物质最多可以消耗2mol的Br2
难度: 中等查看答案及解析
-
下列实验中,分离提纯的方法正确的是
选项
实验
分离、提纯方法
A
除去苯中的环己烯
加入浓溴水后分液
B
高级脂肪酸钠盐溶液中混有甘油
盐析过滤
C
除去乙烷中乙炔气体
用酸性高锰酸钾溶液洗气
D
除去乙醇中乙酸
蒸馏
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
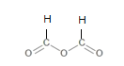
乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示为CH2=C=O+HA → CH3—CO—A。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
A.与HCl加成生成CH3COCl
B.与H2O加成生成CH3COOH
C.与CH3COOH加成生成CH3COOCOCH3
D.与CH3OH加成生成CH3COCH2OH
难度: 简单查看答案及解析
-
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是
编号
HX
YOH
溶液的体积关系
①
强酸
强碱
V(HX)=V(YOH)
②
强酸
强碱
V(HX)<V(YOH)
③
强酸
弱碱
V(HX)=V(YOH)
④
弱酸
强碱
V(HX)=V(YOH)
A.①③ B.②④
C.①④ D.②③
难度: 中等查看答案及解析
-
在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
难度: 中等查看答案及解析
-
下列表述正确的是
A
B
C
D
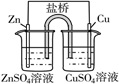
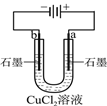


盐桥中的Cl-移向CuSO4溶液
a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝,该气体为氧气
粗铜的电极反应式为:Cu2++2e-=Cu
正极反应式为:O2+4e-+2H2O=4OH-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
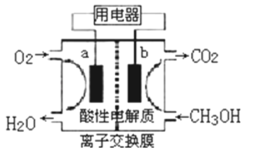
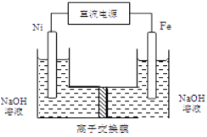
某二次电池充、放电的化学方程式为:2K2S2+KI3
K2S4+3KI,与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红.则下列说法正确的是
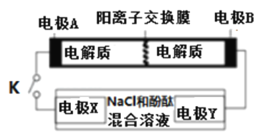
A.K+从右到左通过阳离子交换膜
B.A的电极反应式为:3I﹣﹣2e﹣=I3﹣
C.当有0.1molK+通过离子交换膜,X电极上产生标准状况的气体1.12L
D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应
难度: 中等查看答案及解析
-
烯烃复分解反应是指在一定催化剂作用下碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃:RCH=CHR和R'CH=CHR'。则分子式为C4H8的烯烃中,任取两种烯烃发生“复分解反应”,生成新烯烃种类最多的一种组合中(不考虑顺反异构),其生成新的烯烃的种类为
A.5种 B.4种 C.3种 D.2种
难度: 中等查看答案及解析
-
一种芳纶纤维的拉伸强度比钢丝还高,具有较强热塑性,广泛用作防护材料。其结构片段如图,下列关于该高分子的说法正确的是
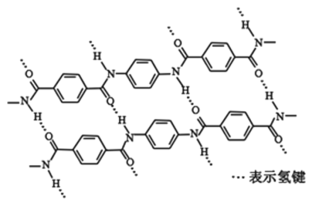
A.完全水解产物的单个分子中,苯环上具有不同化学环境的氢
B.高分子的结构简式可表示为:
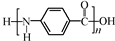
C.氢键对该高分子性能有一定影响
D.芳纶纤维为体型高分子材料
难度: 中等查看答案及解析
-
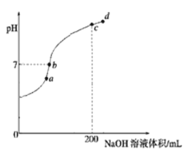
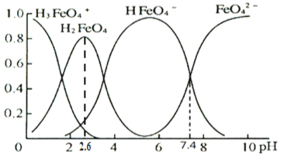
25℃时,向10mL0.1mol/LNa2CO3溶液中逐滴加入20mL0.1mol/L的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
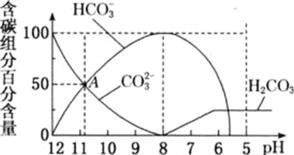
A.HCl溶液滴加一半即10mL时,溶液pH>7
B.0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C.在A点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.当pH=5时,溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
难度: 中等查看答案及解析
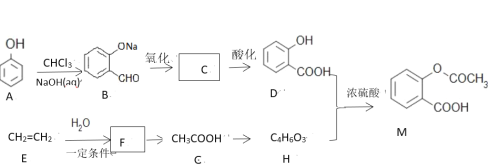
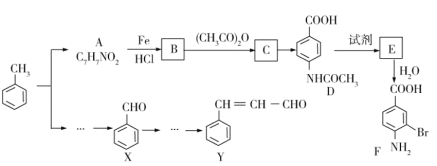
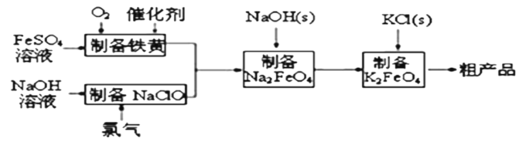
 )是一种常见药物,其中一种合成路线:
)是一种常见药物,其中一种合成路线: