-
高铁酸钾是绿色、环保型水处理剂。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
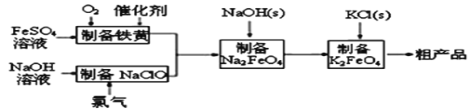
回答下列问题:
(1)已知:常温下,Ksp[Fe(OH)3]=4.0×10—38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=____mol•L﹣1
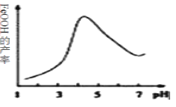
(2)制备铁黄的离子方程式为__________。实验测得反应溶液的pH对铁黄产率的影响如图所示。pH大于4.5时铁黄产率逐渐降低的主要原因可能是__________。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
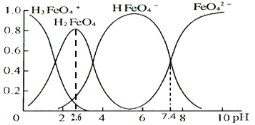
①pH=2.6时,溶液中主要含铁形体浓度的大小关系为________。
②已知H3FeO4+电离常数分别为:K1=2.51×10—2,K2=4.16×10—4,K3=5.01×10—8,当pH=4时,溶液中 =________。
=________。
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为__________;其中可循环使用的物质____________。

-
高铁酸钾是绿色、环保型水处理剂。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程:
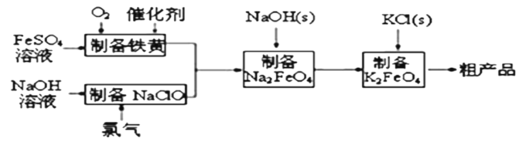
回答下列问题:
(1)已知:常温下,Ksp[Fe(OH)3]=4.0×10—38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_______________mol•L﹣1
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________。

(3)①高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
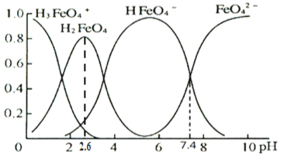
pH=2.6时,溶液中主要含铁形体浓度的大小关系为________。
②已知H3FeO4+电离常数分别为:K1=2.51×10—2,K2=4.16×10—4,K3=5.01×10—8,当pH=4时,溶液中 =________。
=________。
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应式为__________;其中可循环使用的物质____________。
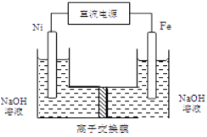
-
下列生产工艺能体现“绿色化学”或节能环保思想的是
A.工业制氢气:用天然气发电再电解水制得
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:使用向稀硫酸中吹空气并加热溶解铜
D.降低PM2.5:用油改煤技术,推广优质煤的使用范围
-
硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
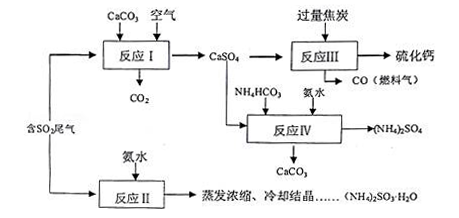
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
-
(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为________。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是________。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是________,原因是。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为________,分子的空间构型为________。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为________。

-
工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为______.
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于______晶体.
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是______.
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是______,原因是______.
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为______,分子的空间构型为______.
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为______.
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
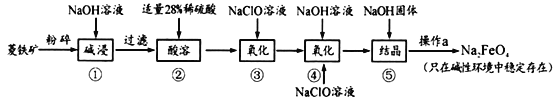
(1)Na2FeO4中铁元素的化合价为_____________,高铁酸钠用于杀菌消毒时的化学反应类型为_______________(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH___________ (填“能”或“不能”),理由是________________________。
(3)步骤③中检验Fe2+全部转化成Fe3+的方法是:___________________________。
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_____________。己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)生产过程中,理论上每获得0.5mol的FeO42-消耗 NaClO的总质量为_______________。
(6)已知几种物质在20℃时的Ksp如下表:
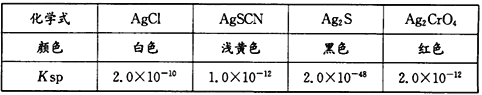
某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是_____(填编号)。
A.KCl B.KSCN C.K2S D.K2CrO4
若取晶体样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用cmol/LAgNO3溶液滴定至终点消耗标准溶液bmL。则x的表达式为___________。
-
(09年江苏化学·16)(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

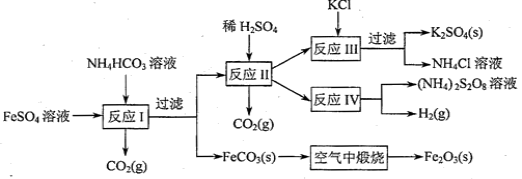
 (1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
(1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
 A.锌粉 B.铁屑 C.KI溶液 D.H2
A.锌粉 B.铁屑 C.KI溶液 D.H2
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:
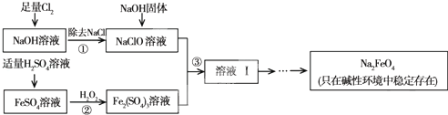
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
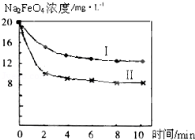
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:
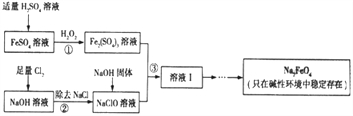
(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
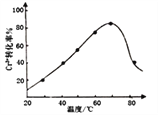
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。



=________。














