-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:
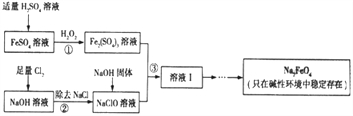
(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
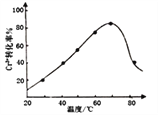
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:
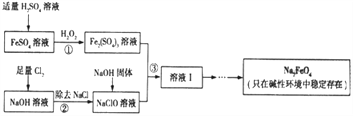
(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
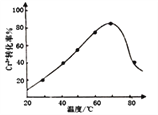
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:
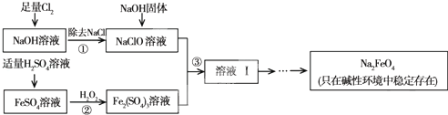
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
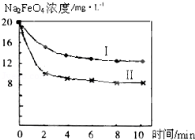
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
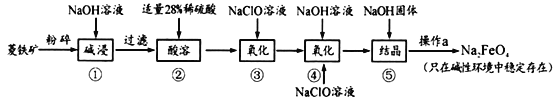
(1)Na2FeO4中铁元素的化合价为_____________,高铁酸钠用于杀菌消毒时的化学反应类型为_______________(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH___________ (填“能”或“不能”),理由是________________________。
(3)步骤③中检验Fe2+全部转化成Fe3+的方法是:___________________________。
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_____________。己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)生产过程中,理论上每获得0.5mol的FeO42-消耗 NaClO的总质量为_______________。
(6)已知几种物质在20℃时的Ksp如下表:
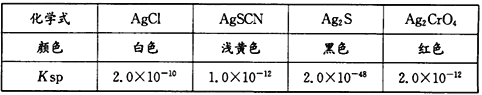
某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是_____(填编号)。
A.KCl B.KSCN C.K2S D.K2CrO4
若取晶体样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用cmol/LAgNO3溶液滴定至终点消耗标准溶液bmL。则x的表达式为___________。
-
化学在生产、生活中有着广泛的应用,下列说法不正确的是( )
A. 新型水处理剂高铁酸钠(Na2FeO4)既是消毒剂又是净水剂
B. 草木灰(主要成分为K2CO3)和铵态氮肥混合施用会降低肥效
C. 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3)的碱性
D. 除去废水中的Cu2+,Ag+等重金属离子可选用硫化钠溶液
-
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
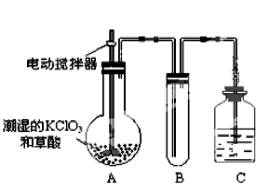
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请回答下列问题:
①A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
A部分还应添加温水浴控制60℃的温度,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A、B或C”)
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
-
高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂,工业上常用以下反应制备:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;对于该反应,下列说法正确的是( )
A.NaClO是还原剂,反应中被还原
B.Fe(OH)3中铁元素化合价升高
C.NaOH是氧化剂
D.该反应是置换反应
-
化学与生活、生产、科技密切相关。下列说法错误的是( )
A.碳酸钠溶液显碱性,可以用作厨房洗涤剂
B.明矾可用作净水剂
C.高铁酸钠具有强氧化性,可以用来对水消毒
D.SO2具有漂白性,可用于食品增白
-
FeCl3 具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3 高效。请回答下列问题:(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
(1)FeCl3净水的原理是________________(用离子方程式表示),Fe3+水解生成的Fe(OH)3 胶体粒子能吸附水中的悬浮杂质,常温下此水解反应的平衡常数为_____________(填写数值)。
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入____________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。
(3)工业上由CuCl2·2H2O晶体制备无水CuCl2的合理方法是在HCl气氛中加热,若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_________________________ (用化学方程式表示)。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下①取0.36 g试样溶于水,加入过量KI固体,发生反应2Cu2++4I-===2CuI↓+I2,生成白色沉淀。②用0.100 0 mol·L-1Na2S2O3标准溶液滴定生成的I2,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(已知:I2+2S2O32-===S4O62-+2I-)
①滴定过程可选用________作指示剂,滴定终点时的现象是_______________________。
②该试样中CuCl2·2H2O的质量分数为________。
-
FeCl3具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3高效。请回答下列问题:已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3
(1)FeCl3净水的原理是______。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为______(填写数值)。
(2)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=______mol•L-1。
(3)FeCl3在溶液中分三步水【解析】
Fe3++H2O⇌Fe(OH)2++H+ K1
Fe(OH)2++H2O⇌ +H+ K2
+H+ K2
 +H2O⇌Fe(OH)3+H+ K3
+H2O⇌Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_________。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O⇌ +yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
a.降温 b.加水稀释 c. 加入NaHCO3d.加入NH4Cl
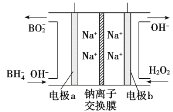
(4)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图所示:

①电解过程中阳极的电极反应式为______。
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图所示。电极a与甲池中_______(填“石墨”或“铁丝网”)连接,电极b的反应式为________。

易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
转化为Cr3+,再将Cr3+转化为沉淀。

,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。








