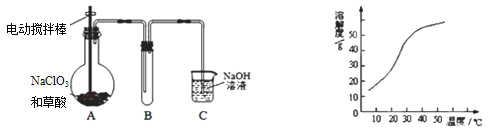
-
根据SO2通入不同溶液中实验现象,所得结论不正确的是
实验
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2 有还原性
B
H2S 溶液
产生黄色沉淀
SO2 有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2 有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3> H2SiO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
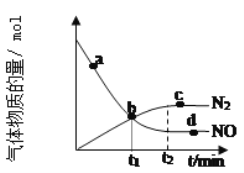
下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成 NO2
②铵盐都不稳定,受热分解都生成氨气
③向 Fe(NO3)2 溶液中滴加稀盐酸,无明显的变化
④实验室加热氯化铵固体的方法制备氨气
A.①③④ B.①③ C.①④ D.①②③④
难度: 简单查看答案及解析
-
X、Y、Z、W是四种原子序数依次增大的短周期元素,Z、W可以形成两种重要化合物ZW2、Z2W2,X、Y的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2:的结构式为Y≡X-Z-Z-X≡Y。下列说法正确的是( )
A.化合物Z2W2中含有离子键
B.简单离子半径大小顺序:ry> rw> rz
C.元素W的氧化物对应水化物的酸性比Y的强
D.X和Z组成的化合物中可能所有原子都达到8电子稳定结构
难度: 困难查看答案及解析
-
化学与生产生活密切相关,下列说法正确的是( )
A.太阳能光催化技术可以将二氧化碳转化为燃料,该燃料属于一次能源
B.75%酒精可用于杀死新冠病毒,如果用90%酒精效果更好
C.二氧化硫具有氧化性,因此可作食品的漂白剂
D.氮气的化学性质稳定,因此可用作食品的保鲜剂
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.CaH2 的电子式:[H:]-Ca2+[:H]-
B.Cl‒的结构示意图:
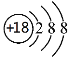
C.质子数为92、中子数为146 的U原子:
D.H2O2的电子式:
难度: 简单查看答案及解析
-
下列说法正确的是:
①只由非金属元素形成的化合物一定是共价化合物
②只含有共价键的化合物一定是共价化合物
③离子化合物中存在离子键,也可能存在极性键和非极性键
④只有非金属元素原子间才能形成共价键
⑤Mg2+的半径小于 N3-的半径
⑥H2O 比 H2S 稳定是因为水分子间存在氢键
A.①②⑤ B.②③④ C.②③⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为
A.1.0g B.2.0g C.2.5g D.3.5g
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CaO+H2O=Ca(OH)2为放热反应,可利用该反应设计原电池,把化学能转化为电能
B.任何化学反应中的能量变化都表现为热量变化
C.有化学键断裂的过程一定是化学变化
D.灼热的铂丝与 NH3、O2混合气接触,铂丝继续保持红热,说明氨的催化氧化反应是放热反应
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应A(g)+B(g)=C(g),若反应物A浓度从2mol·L-1降到0.8mol·L-1需20s,则反应物A的浓度由0.8mol·L-1降到0.2mol·L-1所需的反应时间( )
A.等于10s B.大于10s C.小于10s D.无法判断
难度: 简单查看答案及解析
-
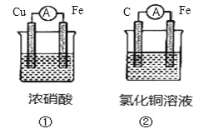
化学能可与热能、电能等相互转化。下列说法正确的是( )
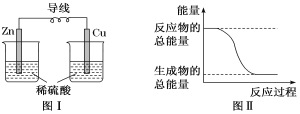
A.图Ⅰ所示的装置能将化学能转化为电能
B.中和反应中,反应物的总能量比生成物的总能量低
C.化学反应中能量变化的主要原因是化学键的断裂与形成
D.图Ⅱ所示的反应为吸热反应
难度: 中等查看答案及解析
-
含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I−+Cl2=I2+2Cl−
B. x=1.2a,10Fe2++14I−+12Cl2=10Fe3++7I2+24Cl−
C. x=1.4a,4Fe2++10I−+7Cl2=4Fe3++5I2+14Cl−
D. x≥1.5a,2Fe2++4I−+3Cl2=2Fe3++2I2+6Cl−
难度: 困难查看答案及解析
-
下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
A.
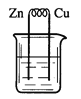 B.
B. 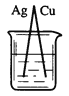 C.
C. 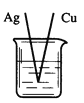 D.
D. 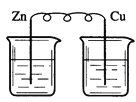
难度: 简单查看答案及解析
-
工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
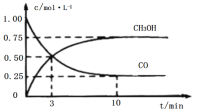
A.反应的化学方程式:CO+2H2⇌CH3OH
B.反应进行至3分钟时,正、逆反应速率相等,反应达到平衡状态
C.反应至10分钟,CO的转化率为75%
D.反应至3分钟,用甲醇来表示反应的平均速率为
mol/(L·min−1)
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 简单查看答案及解析
-
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
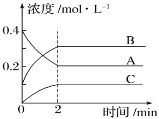
A.发生的反应可表示为2A(g)
2B(g)+C(g)
B.开始时,正、逆反应同时开始
C.前2min内A的分解速率为0.1mol·L-1·min-1
D.2min时,A、B、C的浓度之比为2∶3∶1
难度: 中等查看答案及解析
-
把金属 X 放入盐 Y(NO3)2 的溶液中,发生如下反应:X+Y2+=X2++Y,以下叙述正确的是( )
A.常温下金属 X一定能与水反应,Y一定不能与水反应
B.X 与 Y用导线连接后放入CCl4中,一定形成原电池
C.X、Y用导线连接后放入Y(NO3)2的溶液中,一定有电流产生
D.由X与Y做电极形成的原电池中,X一定是负极,Y一定是正极
难度: 中等查看答案及解析