-
新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于新能源的是
①煤 ②火力发电 ③太阳能 ④生物质能 ⑤石油 ⑥氢能
A. ①②③ B. ③④⑥
C. ②③⑤ D. ②④⑤
难度: 中等查看答案及解析
-
某化学反应的能量变化如下图所示。下列有关叙述正确的是
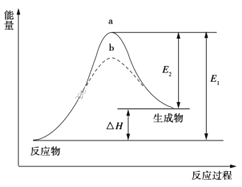
A. 该反应的反应热ΔH=E2-E1
B. a、b分别对应有催化剂和无催化剂的能量变化。
C. 催化剂不能改变反应的活化能。
D. 催化剂能改变反应路径,但不能改变反应的焓变。
难度: 中等查看答案及解析
-
已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;
H2SO4(浓)+NaOH(aq)===
Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
A. 上述热化学方程式中的计量数表示分子数。
B. ΔH1>ΔH2
C. ΔH2应为
H2SO4(浓)溶于水的能量变化与中和热之和。
D. |ΔH1|〈|ΔH2|
难度: 中等查看答案及解析
-
关于如图中四个图像的说法正确的是

注:图中,E表示能量,p表示压强,t表示时间,y表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。
难度: 困难查看答案及解析
-
已知反应A(g)+B(g)
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃
700
830
1200
K值
1.7
1.0
0.4
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
难度: 中等查看答案及解析
-
浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg
的变化如图所示。下列叙述正确的是
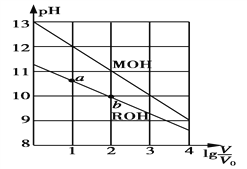
A. MOH为弱碱,ROH为强碱
B. ROH的电离程度:a点大于b点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg
=2时,若两溶液同时升高温度,则
增大
难度: 困难查看答案及解析
-
下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO3-、NH4+
NaHSO4溶液
3Fe2++NO3- +4H+=3Fe3++NO↑+2H20
B
Ca2+、HCO3-、Cl-
少量NaOH溶液
Ca2++2HCO3- +2OH-=2H2O+CaCO3↓+CO32-
C
K+、AlO2-、HCO3-
通入少量CO2
2AlO2-+3H2O+CO2=2Al(OH) 3↓+CO32-
D
NH4+、Al3+、SO42-
少量Ba (OH) 2溶液
2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
难度: 中等查看答案及解析
-
常温下,将浓度均为0.1 mol/L HA溶液和NaOH溶液等体积混合,混合溶液的pH=9,下列说法正确的是
A. 该混合溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. 该混合溶液中:c(HA)+c(A-)=0.1 mol/L
C. 常温下,0.1 mol/L HA溶液的pH=1
D. 0.1 mol/L HA溶液中:c(HA)>c(A-)
难度: 中等查看答案及解析
-
已知:25 ℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断不正确的是
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)较小。
B. 25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大。
C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L的氨水中的Ksp与在20 mL 0.01 mol/L NH4Cl溶液中的Ksp相同,但前者的溶解度比后者小。
D. 25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2。
难度: 中等查看答案及解析
-
碱性锌锰电池获得了广泛的使用,根据电池的电极反应,下列判断正确的是
A. Zn为负极,MnO2为正极。
B. Zn为正极,MnO2为负极。
C. 工作时电子由MnO2经外电路流向Zn极。
D. Zn电极发生还原反应,MnO2电极发生氧化反应。
难度: 中等查看答案及解析
-
为保护地下钢管不受腐蚀,可使它与
A. 交流电源火线相连 B. 铜板相连
C. 锌板相连 D. 直流电源正极相连
难度: 中等查看答案及解析
-
根据如图回答,下列说法正确的是
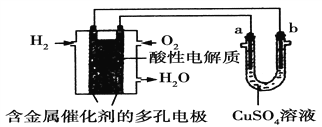
A. 此装置若用于铁表面镀铜时,a为铁。
B. 此装置若用于电镀铜时,硫酸铜溶液的浓度逐渐变小。
C. 燃料电池中正极反应为:O2+4e-+2H2O===4OH-
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,b电极上增重63.5 g,a电极下方有部分重金属泥。
难度: 中等查看答案及解析
-
纯净物X、Y、Z转化关系如图所示,下列判断不正确的是
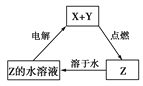
A. X可能是金属铜 B. Y可能是氢气
C. Z可能是氯化钠 D. Z不可能是三氧化硫
难度: 中等查看答案及解析
-
温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g)
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(Y)/mol
0
0.32
0.38
0.40
0.40
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)
难度: 困难查看答案及解析
-
用标准盐酸滴定未知浓度的氨水,下列操作引起实验误差分析不正确的是
A. 用蒸馏水洗净碱式滴定管后,装入未知浓度的氨水,再移取10.00 mL氨水至锥形瓶,最终会使实验结果偏低。
B. 用蒸馏水洗净锥形瓶后,再用氨水润洗,后装入氨水,然后进行滴定,最终会使实验结果偏高。
C. 用酸式滴定管盛放盐酸溶液,滴定前开始调节液面时,仰视读数,最终会使实验结果偏低。
D. 用酚酞作指示剂滴至红色刚变无色后,要等半分钟,若溶液红色不褪去,表明达到滴定终点。
难度: 中等查看答案及解析