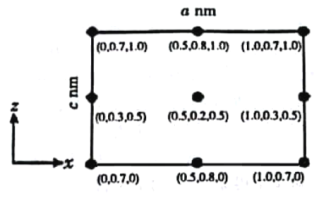
-
2020年春季爆发了新型冠状病毒疫情,该病毒具有极强的传染性,杀菌消毒,做好个人防护是防止疫情蔓延的重要措施。下列有关说法中错误的是
A.医用酒精消毒液中乙醇的体积分数为75%
B.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料
C.84消毒液与酒精混用杀菌消毒效果更好
D.二氧化氯泡腾片具有强氧化性,有良好除臭、脱色、杀菌作用,具有低浓度高效灭杀病毒能力
难度: 中等查看答案及解析
-
维生素C又称抗坏血酸,能增强对传染病的抵抗力,有解毒作用等,其结构式为
 ,下列有关说法错误的是
,下列有关说法错误的是A.维生素C分子式为C6H8O6
B.维生素C的同分异构体中可能有芳香族化合物
C.向维生素C溶液中滴加紫色石蕊试液,溶液颜色变红,说明维生素C溶液显酸性
D.在一定条件下,维生素C能发生氧化反应、加成反应、取代反应和消去反应
难度: 中等查看答案及解析
-
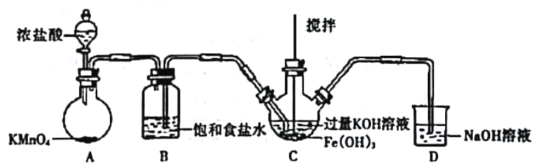
为达到实验目的,下列选用的装置、实验操作均正确的是
实验目的
实验步骤和装置
A
比较H2O2和Fe3+的氧化性
将盐酸酸化的双氧水滴入Fe(NO3)2溶液中
B
配制100 mL 1.0 mol·L-1NaOH溶液
向100mL容量瓶中加入4.0 g NaOH固体,加水到刻度线
C
验证牺牲阳极的阴极保护法
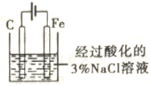
往铁电极附近滴加铁氰化钾溶液
D
探究温度对反应速率的影响
将两片大小相同的淀粉碘化钾试纸分别放置于两支规格相同的试管中,向试纸上滴加2.0 mol·L-1的H2SO4溶液2~3滴,密封试管,分别在室温和40℃水浴中反应,观察并记录变色时间
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
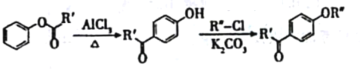
苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
+(CH3CO)2O(乙酸酐)
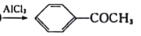 +CH3COOH, NA代表阿伏加德罗常数的值。下列有关说法正确的是
+CH3COOH, NA代表阿伏加德罗常数的值。下列有关说法正确的是A.1 mol苯所含的化学单键数目为12NA
B.0.1 mol乙酸酐中含有的电子数目为5.4NA
C.气态苯乙酮的密度是气态乙酸密度的2倍
D.1L 2 mol·L-1 CH3COOH溶液与足量钠反应生成的气体分子数为NA
难度: 中等查看答案及解析
-
CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
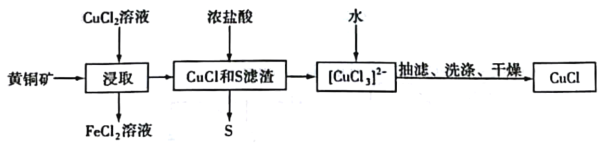
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)⇌[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s) +2Cl-(aq)⇌[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
难度: 中等查看答案及解析
-
短周期元素X、Y 、Z、M、N位于元素周期表中五个不同的族,且原子序数依次增大,其中只有N为金属元素。X元素的原子形成的阴离子的核外电子排布与氦原子相同;自然界中Y元素形成的化合物的种类最多;Z、M在元素周期表中处于相邻位置,它们的单质在常温下均为无色气体。下列说法错误的是
A.五种元素的原子半径从大到小的顺序:N>Y>Z>M>X
B.Y、Z、M三种元素都能与X元素形成含有非极性健的化合物
C.N的最高价氧化物对应的水化物可能是强碱
D.X与Y、Z、M形成的简单化合物,沸点逐渐升高
难度: 中等查看答案及解析
-
常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是
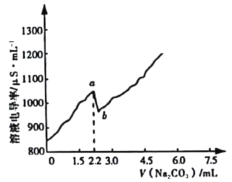
A.a点对应的溶液中Ca2+开始形成沉淀,溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
D.右图可以说明CaCO3在溶液中存在过饱和现象
难度: 困难查看答案及解析