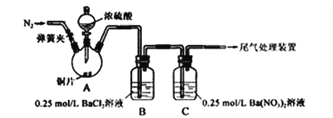
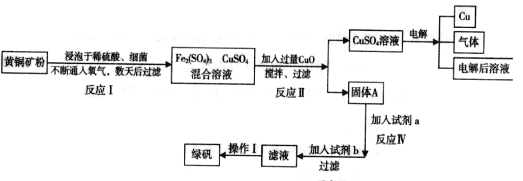
-
下列有关物质的性质与用途有对应关系的是
A. Al2O3熔点高,可用作耐高温材料 B. NH4HCO3 受热易分解,可用作氮肥
C. Fe2(SO4)3易溶于水,可用作净水剂 D. SO2 具有氧化性,可用于漂白纸浆
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大,古文献中充分记载了古代化学研究成果。下列关于古代化学的应用和记载的解释不合理的是
A. 《本草纲目》中记载“火药乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”。这是利用了“KNO3的氧化性”
B. 李白有诗云“日照香妒生紫烟”,这是描写“碘的升华”
C. 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”
D. 我国古代人民常用明矾水除去铜器上的铜锈[Cu(OH)2CO3],利用了明矾水的酸性
难度: 中等查看答案及解析
-
化学与生产、生活及环境密切相关,下列有关说法正确的是
A. 酸雨的pH在5.6-7.0之间
B. 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒
C. 用于光缆通信的光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料
D. “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
难度: 中等查看答案及解析
-
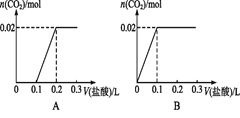
下列解释事实的方程式正确的是
A. 石灰水表面漂着的“白膜”可用醋酸溶【解析】
CaCO3+2H+=Ca2++CO2↑+H2OB. 氢氧化铁沉淀溶于氢碘酸中: Fe(OH)3+3H+=Fe3++3H2O
C. 盐碱地( 含较多NaCl 、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为Ca2++CO32-=CaCO3 ↓
D. 漂白粉溶液在空气中失效:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓
难度: 中等查看答案及解析
-
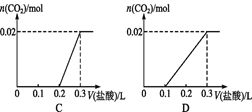
下列有关化学实验的设计合理的是
A. 采用蒸馏的方法分离碘的四氯化碳溶液
B. 用氢氟酸清洗做过硅酸分解实验的瓷坩埚
C. H2S 气体通入CuSO4溶液,比较氢硫酸和硫酸的酸性
D. 向氯化亚铁溶液中滴加酸性高锰酸钾溶液,证明溶液中含有Fe2+
难度: 中等查看答案及解析
-
25℃时,将agNH3完全溶于水,得到VmLpH=8的氨水,假设该氨水密度为ρg·cm3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中一定正确的是
A. 溶质的物质的量浓度c=
mol·L-1
B. 溶质的质量分数为ω=
×100%
C. c(OH-)=(
+10-8) mol· L-1
D. 为使溶液的质量分数等于0.5 ω,应加入V mL水
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:H++ SO42-+ Ba2++OH-= BaSO4↓+ H2O
B. 饱和FeCl3滴入沸水中加热煮沸制备胶体:Fe3++3H2O=Fe(OH)3(胶体)+ 3H+
C. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: 3ClO-+2Fe(OH)3= 2FeO42-+3Cl-+H2O+4H+
D. 向含有0.4mol FeBr2的溶液中通入0.4molCl2充分反应:4Fe2++2Br-+3C12=4Fe3++6C1-+ Br2
难度: 困难查看答案及解析
-
A是中学化学中常见的单质,B、C为化合物,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断不正确的是
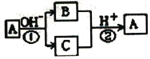
A. A、B、C一定含有一种相同的元素 B. A可能是金属,也可能是非金属
C. B、C的水溶液可能呈碱性或中性 D. 反应①和②一定都是氧化还原反应
难度: 困难查看答案及解析
-
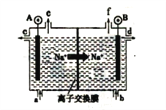
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
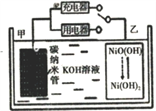
A. 充电时,电池的碳电极与直流电源的正极相连
B. 放电时,甲电极为负极,电极反应为: H2-2e‾═2H+
C. 充电时,乙电极反应式为:NiO(OH)+H2O+e‾═Ni(OH)2+OH‾
D. 电池总反应为H2+2NiO(OH)
2Ni(OH)2
难度: 困难查看答案及解析
-
工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水
Mg(OH)2
MgO
Mg
B. 冶炼铝:铝土矿
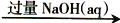 NaAlO2
NaAlO2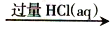 无水AlCl3
无水AlCl3Al
C. 制硝酸:N2、H2
 NH3
NH3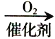 NO
NO50%HNO3
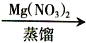 浓HNO3
浓HNO3D. 海带
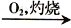 海带灰
海带灰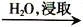
I2(aq)
 I2
I2难度: 中等查看答案及解析
-
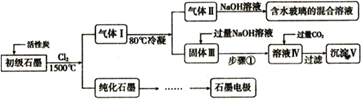
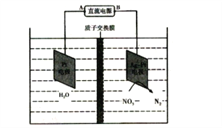
某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
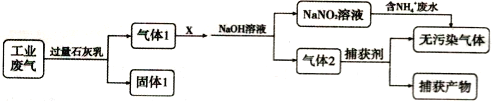
A. 固体1中只含有CaCO3和CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:5NH4++3NO2-==4N2↑+6H2O+H+
难度: 困难查看答案及解析
-
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
难度: 困难查看答案及解析