-
下列说法正确的是( )。
A.自然界中的所有原子都处于基态
B.同一原子处于激发态时的能量一定高于基态时的能量
C.无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D.激发态原子的能量较高,极易失去电子,表现出较强的还原性
难度: 中等查看答案及解析
-
下列能层的能量由低到高的顺序是( )
A.K、M、N、L B.L、M、N、O
C.M、N、Q、P D.M、N、P、O
难度: 简单查看答案及解析
-
下列能级符号表示错误的是( )
A.1s B.3p C.2d D.4f
难度: 简单查看答案及解析
-
下列各原子或离子的电子排布式错误的是( )
A.Na:1s22s22p63s1 B.F:1s22s22p5
C.N3−:1s22s22p6 D.O2−:1s22s22p4
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.Ⅷ族分布在 d 区 B.s 区、d 区、ds 区都是金属元素
C.p 区都是主族元素 D.最外层电子数为 2 的元素都分布在 s 区
难度: 简单查看答案及解析
-
下列关于电子云的叙述中不正确的是( )
A.电子云并不是电子实际运动形成的图形
B.电子云是用小黑点的疏密程度来表示电子在核外空间出现概率大小的图形
C.电子云图说明离核越近,电子出现概率越大;离核越远,电子出现概率越小
D.同一原子不同能层的 s 能级电子云轮廓图的形状相同,半径相等
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.因为 p 轨道是哑铃形,所以 p 能级上电子运行的轨迹就是哑铃形
B.M 能层有 3s、3p、3d 能级,共 9 个轨道
C.Li 原子中只有 3 个电子,故 Li 原子核外只有 2 个轨道
D.第 n 能层的原子轨道数为 2n2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.Na、Mg、Al的第一电离能逐渐增大
B.V、Cr、Mn的最外层电子数逐渐增大
C.S2﹣、Cl﹣、K+的半径逐渐减小
D.O、F、Ne的电负性逐渐增大
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氢键具有方向性和饱和性
B.分子内键能越小,表示该分子受热越难分解
C.在分子中,两个成键的原子间的距离叫键长
D.对于由分子构成的物质,相对分子质量越大,其熔沸点一定越高
难度: 简单查看答案及解析
-
下列关于基态硅原子的核外电子排布的表示方法中,正确的是( )
A.[Ne] 3s23p1
B.1s22s22p63s13p3
C.

D.

难度: 简单查看答案及解析
-
下列有关多电子原子的叙述中正确的是( )
A.在一个多电子原子中,不可能有两个运动状态完全相同的电子
B.在一个多电子原子中,不可能有两个能量相同的电子
C.Sc 基态原子的电子排布式 1s22s22p63s23p63d3 符合构造原理(能量最低原理)
D.某个多电子原子的 3p 能级上仅有两个电子,它们的自旋状态必须相反
难度: 简单查看答案及解析
-
下列不属于共价键成键因素的是( )
A.共用电子对在两原子核之间出现的概率高
B.共用的电子必须配对
C.两原子体积大小要适中
D.成键后体系能量降低,趋于更稳定
难度: 简单查看答案及解析
-
下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.σ键是镜面对称,而π键是轴对称
C.O2 分子中含π键,是由两个 p 轨道“肩并肩”重叠形成的
D.当原子形成分子时,首先形成σ键,可能形成π键
难度: 简单查看答案及解析
-
下列物质中含有非极性键的离子化合物是( )
A.HBr B.Na2O2 C.C2H4 D.CH3Cl
难度: 简单查看答案及解析
-
下列离子的 VSEPR 模型与其立体构型一致的是( )
A.SO32- B.NO2- C.ClO4- D.ClO3-
难度: 简单查看答案及解析
-
若 X、Y 两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y 只能是离子
B.若 X 提供空轨道,则配位键表示为 X→Y
C.X、Y 分别为 Ag+、NH3 时形成配位键,Ag+作配体
D.若 X 提供空轨道,则 Y 至少要提供一对孤电子对
难度: 简单查看答案及解析
-
下列各组物质中,都是由极性键构成的极性分子的是( )
A.NH3 和 H2O B.CO2 和 HCl C.CH4 和 H2S D.HCN 和 BF3
难度: 简单查看答案及解析
-
下列化学键中,键的极性最强的是( )
A.H—C B.H—O C.H—N D.H—F
难度: 简单查看答案及解析
-
以下有关杂化轨道的说法中正确的是( )
A.sp3 杂化轨道中轨道数为 4,且 4 个杂化轨道能量相同
B.杂化轨道既可能形成σ键,也可能形成π键
C.杂化轨道不能容纳孤电子对
D.sp2杂化轨道最多可形成 2 个σ键
难度: 简单查看答案及解析
-
下列分子或离子中键角由大到小的排列顺序是( )
①CO32- ②NH3 ③H2O ④SiF4 ⑤CO2
A.⑤④①②③ B.④①②⑤③
C.⑤①④②③ D.③②④①⑤
难度: 简单查看答案及解析
-
下列关于晶体与非晶体的说法正确的是( )
A.晶体与非晶体的本质区别在于是否有固定的熔沸点
B.晶体有自范性的原因是粒子在微观空间呈周期有序性排列
C.固体食盐、水晶、塑料、胆矾、玻璃均属于晶体
D.区别晶体与非晶体的最科学可靠的方法是检测其是否具有各向异性
难度: 简单查看答案及解析
-
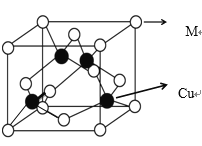
C60 晶体的晶胞结构如图所示,下列说法正确的是( )
A.该晶体熔化时需克服共价键
B.1个晶胞中含有 8 个 C60 分子
C.晶体中 1 个 C60 分子有 12 个紧邻的C60 分子,属于分子密堆积类型
D.晶体中 C60 分子间以范德华力结合,故 C60 分子的热稳定性较差
难度: 简单查看答案及解析
-
下列有关晶体叙述中,正确的是( )
A.熔点 I2>Cl2;沸点 PH3>NH3
B.熔点 SiO2>CO2; C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
C.原子晶体的结构粒子是原子,故原子晶体都不导电
D.金属晶体的导电导热性均与自由电子密切相关
难度: 简单查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或折开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为

A.-1 638 kJ/mol B.+1 638 kJ/mol C.-126 kJ/mol D.+126 kJ/mol
难度: 困难查看答案及解析