-
现有A、B、C、D四种金属片:
①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;
②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。
根据上述情况,下列说法中正确的是( )
A.在①中,金属片B发生还原反应
B.在②中,金属片C作正极
C.如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生
D.上述四种金属的活动性由强到弱的顺序是:A>B>C>D
难度: 中等查看答案及解析
-
在一定条件下,RO3-与R-可发生反应,RO3-+5R-+6H+=3R2+3H2O,下列关于R的叙述中,正确的是
A.R可能是金属
B.元素R位于周期表中第VA族
C.R形成的单质在常温常压下一定是气体
D.反应中氧化产物与还原产物的物质的量之比是5:1
难度: 中等查看答案及解析
-
元素周期率和元素周期表把构成万物的基本元素组成了一个相互联系的完整体系,简单、清晰却非常深刻地揭示出复杂物质世界的内在规律。它的出现,使化学研究实现从现象到本质的根本性飞 跃,是化学作为一门科学的重要理论基石。下列关于元素周期率和元素周期表的说法正确的是
A.元素周期律是指元素的性质随着相对原子质量的增大而呈周期性的变化
B.元素周期表中目前发现的原子是 118 种
C.我们现在广泛使用的长式元素周期表有 18个纵行 18个族
D.除了稀有气体元素之外,其它非金属元素都是主族元素
难度: 中等查看答案及解析
-
下列叙述正确的是
①干冰晶体气化时需破坏分子间作用力
②HClO 分子的结构式:H—Cl—O
③NH4Cl 的电子式
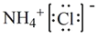
④H2O2分子中既含极性共价键,又含非极性共价键
⑤由于 H—F 键比 H—Cl 键强,所以 HF 的沸点比 HCl 的沸点高
⑥NaHSO4 在溶于水时发生电离,破坏了离子键和共价键
⑦用电子式表示溴化氢的形成过程为:

A.①②⑤ B.②④⑥ C.③⑤⑦ D.①④⑥
难度: 中等查看答案及解析
-
钼元素为人体及动植物必须的微量元素,也在钢铁工业中的有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是
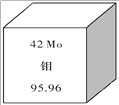
A.95Mo18O42-(钼酸根离子)中共计有 76 个电子
B.95Mo 的相对原子质量是 95.96
C.92Mo、95Mo、98Mo 互为同位素,化学性质几乎相同
D.98Mo 的原子核内有 56 个中子
难度: 中等查看答案及解析
-
下列有关反应事实描述不正确的是
A.灼热的木炭与 CO2反应,反应物总能量低于生成物总能量
B.发生铝热反应时,铝粉与 Fe2O3需要在高温下反应,所以该反应是吸热反应
C.镁条和盐酸反应时,溶液的温度通常会上升
D.氢氧化钡晶体和氯化铵晶体的反应是吸热反应
难度: 中等查看答案及解析
-
原电池中,B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A. A是Zn,B是Cu,C为硝酸 B. A是Cu,B是Zn,C为盐酸
C. A是Fe,B是Ag,C为稀AgNO3溶液 D. A是Ag,B是Fe,C为Cu(NO3)2溶液
难度: 简单查看答案及解析
-
关于化学能与其他能量相互转化的说法正确的是
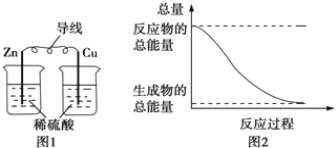
A.图 1 所示的装置能将化学能转变为电能
B.图 2 所示的反应为吸热反应
C.燃料电池工作原理是燃料燃烧放出热能,再将热能转化为电能
D.化学反应中能量变化的主要原因是化学键的断裂与形成
难度: 中等查看答案及解析
-
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是
A.元素的非金属性:Q 强于 W
B.T 的氧化物能与 NaOH 溶液反应
C.R 元素的气态氢化物能与其最高价氧化物对应的水化物反应
D.Q 和 W 元素形成化合物 QW2分子中,各原子的最外层均满足 8 电子的稳定结构
难度: 中等查看答案及解析
-
金刚石和石墨是碳元素的两种同素异形体。在 100kPa 时,1mol 石墨转化为 1mol 金刚石要吸收1.895kJ 的热量,试判断在 100kPa 压强下,下列结论不正确的是
A.石墨比金刚石稳定
B.金刚石和石墨的微观结构不同,性质也不同
C.1mol 石墨比1mol 金刚石的总能量高
D.石墨转化为金刚石是化学变化
难度: 中等查看答案及解析
-
肼(N2H4)又称联氨,是火箭常用的高能燃料,常温下为液体,其球棍分子模型如图所示。肼能与双氧水发生反应 N2H4+2H2O2=N2+4H2O,用 NA表示阿伏加德罗常数的值。下列说法正确的是

A.N2H4属于共价化合物,分子中只含有极性共价键
B.标准状况下,22.4 L N2H4中含有的原子总数为 6NA
C.标准状况下,3.2 g N2H4中含有共价键的总数为 0.6NA
D.若生成 3.6g H2O,则上述反应转移电子的数目为 0.2NA
难度: 中等查看答案及解析
-
已知短周期主族元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述正确的是
A.离子的还原性:C3-<D- B.离子半径:C>D>B>A
C.原子序数: d>c>b>a D.单质的还原性: A>B>D>C
难度: 中等查看答案及解析
-
NF3是一种温室气体,其存储能量能力是 CO2的 12000~20000 倍,在大气中的寿命可长达 740年,如表所示是几种化学键断裂时所需要吸收的能量,下列说法中正确的是
化学键
N≡N
F—F
N—F
1mol 化学键断裂所需要吸收的能量
946kJ
154.8kJ
283 kJ
A.过程 N2 (g)→2N(g)放出能量
B.过程 N(g)+3F(g)→NF3(g)吸收能量
C.反应 N2(g)+3F2 (g)=2NF3(g)为放热反应
D.NF3中元素的化合价:N 为-3价,F 为+1 价
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:
元素
甲
乙
丙
丁
戊
原子半径
0.16
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
下列叙述中正确的是
A.丁与戊形成的化合物可与氢氧化钠溶液反应
B.常温下,乙单质能与丙最高价氧化物对应水化物的浓溶液发生剧烈反应
C.形状、大小完全相同的甲、丁的单质与同浓度稀盐酸反应速率:甲<丁
D.丙单质在戊单质中燃烧,生成一种有刺激性气味的气体,该物质中丙为+6 价
难度: 中等查看答案及解析
-
五种短周期元素 X、Y、Z、M、W 的原子序数与其某常见化合价的关系如图所示,下列关系不正确的是

A.元素 X 可能为锂
B.原子半径大小:r(M)>r(W)
C.Z 元素是形成化合物种类最多的元素
D.气态氢化物的还原性:YH3<MH3
难度: 中等查看答案及解析
-
高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,KOH 溶液为电解质溶液。具有能量密度 大、体积小、重量轻、寿命长、无污染等优点。该电池放电时的总反应为:3Zn+2K2FeO4+8H2O=3Zn(OH) 2+2Fe(OH) 3+4KOH。下列说法不正确的是
A.该电池放电过程中电解质溶液碱性增强
B.正极反应式为 2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-
C.电子由 Zn 电极流出,经 KOH 溶液流向正极
D.该电池在放电时,K+定向移动到电池的正极
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,X、Q 的气态氢化物均极易溶于水,Z 是金属元素,Y 元素和 W 元素位于元素周期表的同一主族,且 W 元素的原子序数是 Y 元素原子 序数的两倍。下列说法不正确的是
A.元素 X 的气态氢化物可与元素 Q 的气态氢化物反应
B.简单离子半径的大小顺序为 W>Q> X>Y >Z
C.元素 X、Y、W 在自然界均能以游离态的形式存在
D.W 元素和 Q 元素的氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
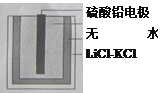
A.正极反应式:Ca+2Cl- - 2e-= CaCl2
B.常温时,在正负极间接上电流表或检流计,指针不偏转
C.放电过程中,Li+向负极移动
D.每转移0.1mol电子,理论上生成20.7g Pb
难度: 中等查看答案及解析


