-
我国在物质制备领域成绩斐然,下列物质属于有机物的是
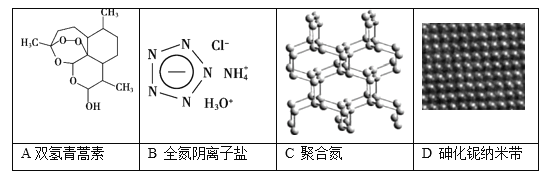
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
难度: 中等查看答案及解析
-
用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
难度: 中等查看答案及解析
-
氮及其化合物的转化过程如图所示。下列分析合理的是
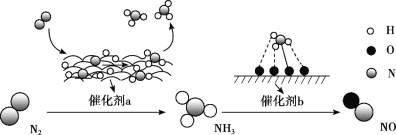
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+
B.pH=12 的溶液:K+、Na+、ClO-、SO32—
C.水电离的 c(OH-)=1×10-13mol·L-1的溶液中:K+、Cl-、CH3COO-、Cu2+
D.0.1 mol·L-1的 K2SO4溶液:Na+、Al3+、Cl—、NO3—
难度: 中等查看答案及解析
-
短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
难度: 中等查看答案及解析
-
乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
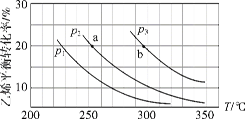
A.乙烯气相直接水合反应的∆H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =
D.达到平衡状态a、b所需要的时间:a>b
难度: 中等查看答案及解析
-
线型 PAA(
)具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
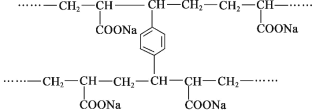
A.线型 PAA 的单体不存在顺反异构现象
B.形成网状结构的过程发生了加聚反应
C.交联剂 a 的结构简式是

D.PAA 的高吸水性与—COONa 有关
难度: 中等查看答案及解析
-
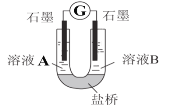
只用如图所示装置进行下列实验,能够得出相应实验结论的是
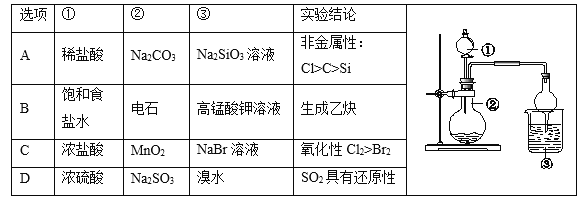
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
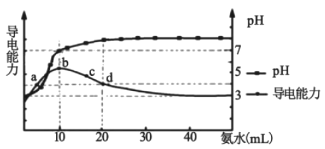
A.各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B.常温下,R- 的水解平衡常数数量级为10 -9
C.a点和d点溶液中,水的电离程度相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3∙H2O)
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
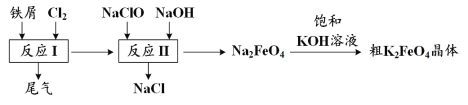
下列叙述错误的是
A.用K2FeO4作水处理剂时,既能杀菌消毒又能净化水
B.反应I中尾气可用FeCl2溶液吸收再利用
C.反应II中氧化剂与还原剂的物质的量之比为3:2
D.该条件下,物质的溶解性:Na2 FeO4< K2FeO4
难度: 困难查看答案及解析
-
国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染。其工作原理如图所示。下列说法正确的是
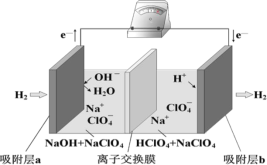
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层 b 发生的电极反应:H2 – 2 e+ 2OH= 2H2O
C.NaClO4 的作用是传导离子和参与电极反应
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
难度: 简单查看答案及解析
-
某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
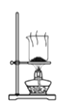
B.将海带灰溶解后分离出不溶性杂质
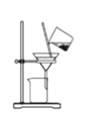
C.制备Cl2,并将I-氧化为I2
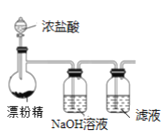
D.以淀粉为指示剂,用Na2SO3标准溶液滴定
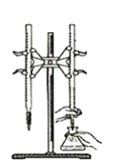
难度: 简单查看答案及解析
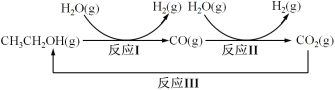
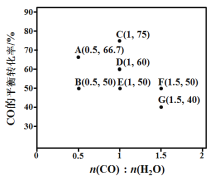
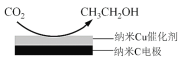
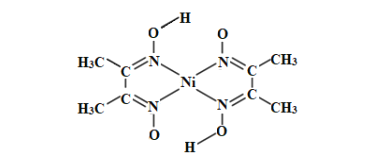
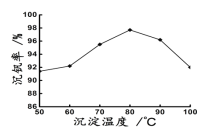
 =1.7)
=1.7)
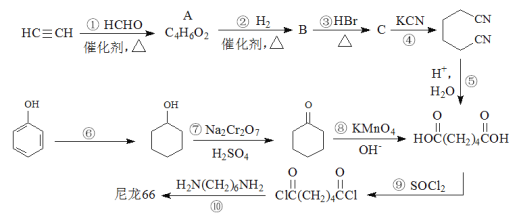
 )是一种生物可降解材料,已知羰基化合物可发生下述
)是一种生物可降解材料,已知羰基化合物可发生下述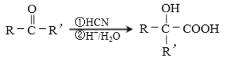 反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________